প্রশ্ন-১। LPG এর পূর্ণরূপ লেখো।
উত্তরঃ LPG এর পূর্ণরূপ হলো— Liquefied Petroleum Gas।
প্রশ্ন-২। সারফেস ওয়াটার কাকে বলে?
উত্তরঃ নদী-নালা, খাল-বিল, হ্রদ, লেক, পুকুর, ঝর্ণা, প্রভৃতির পানিকে সারফেস ওয়াটার বলে।
প্রশ্ন-৩। খর পানি কাকে বলে?
উত্তরঃ সাধারণত যে পানিতে ক্যালসিয়াম, ম্যাগনেসিয়াম ধাতুর বাইকার্বনেট, ক্লোরাইড বা সালফেট লবণ দ্রবীভূত থাকে, তাকে খর পানি বলে।
প্রশ্ন-৪। পানির খরতা কাকে বলে?
উত্তরঃ পানিতে Ca2+ ও Mg2+ এর উপস্থিতিকে পানির খরতা বলে।
প্রশ্ন-৫। DDT কি?
উত্তরঃ ডিডিটি (DDT) হচ্ছে এক ধরনের রাসায়নিক পদার্থ, যার পুরো নাম ডাইক্লোরো ডাইফেনাল ট্রাইক্লোরো ইথেন। এটি একটি কীটনাশক।
প্রশ্ন-৬। মোল ভগ্নাংশ কাকে বলে?
উত্তরঃ কোনো মিশ্রণের একটি উপাদানের মোল সংখ্যাকে উক্ত মিশ্রণের মোট মোল সংখ্যা দ্বারা ভাগ করলে যে ভাগফল পাওয়া যায়, তাকে সে উপাদানের মোল ভগ্নাংশ বলে।
প্রশ্ন-৭। আদর্শ গ্যাস কাকে বলে?
উত্তরঃ যে গ্যাস সকল তাপমাত্রা ও চাপে গ্যাসের সূত্রসমূহ অর্থাৎ বয়েলের সূত্র চার্লসের সূত্র, অ্যাভোগেড্রোর সূত্র প্রভৃতি সঠিকভাবে মেনে চলে তাদেরকে আদর্শ গ্যাস বলে।
প্রশ্ন-৮। নিঃসরণ কাকে বলে?
উত্তরঃ চাপ প্রয়োগে সরু ছিদ্র পথে কোনো গ্যাসের নির্গত বা বের হওয়ার প্রক্রিয়াকে নিঃসরণ বা অণুব্যাপন বলে।
প্রশ্ন-৯। গ্রাহামের ব্যাপন সূত্রটি কী?
উত্তরঃ নির্দিষ্ট তাপমাত্রা ও চাপে যে কোন আদর্শ গ্যাসের ব্যাপন হার তার ঘনত্বের বর্গমূলের ব্যস্তানুপাতিক।
প্রশ্ন-১০। সমতাপীয় রেখা কাকে বলে?
উত্তরঃ স্থির তাপমাত্রায় নির্দিষ্ট ভরের কোনো গ্যাসের উপর বিভিন্ন চাপ প্রয়োগ করে এবং সংশ্লিষ্ট চাপে ঐ গ্যাসের আয়তন লিপিবদ্ধ করে X অক্ষ বরাবর চাপ ও Y অক্ষ বরাবর আয়তন স্থাপন করলে যে সব রেখাসমূহ পাওয়া যায়, তাদের আইসোথার্ম বা সমতাপীয় রেখা বলে।
প্রশ্ন-১১। সমচাপ রেখা কাকে বলে?
উত্তরঃ স্থির চাপে কোনো গ্যাসের আয়তন ও তার পরম তাপমাত্রার বিপরীতে লেখচিত্র অঙ্কন করলে একটি মূলবিন্দুগামী সরলরেখা পাওয়া যায়, এই প্রক্রিয়াটিকে সমচাপ রেখা বলে।
প্রশ্ন-১২। অনুবন্ধী ক্ষারক কাকে বলে?
উত্তরঃ কোনো এসিড থেকে একটি প্রোটন অপসারণের ফলে যে ক্ষারকের সৃষ্টি হয় তাকে ঐ এসিডের অনুবন্ধী ক্ষারক বলে।
প্রশ্ন-১৩। প্রাকৃতিক পাতিত পানি কাকে বলে?
উত্তরঃ বৃষ্টির পানিকে প্রাকৃতিক পাতিত পানি বলে।
প্রশ্ন-১৪। সম-আয়তনীয় লেখ কাকে বলে?
উত্তর : স্থির আয়তনে কোনো গ্যাসের চাপ (P) ও তাপমাত্রা (T)-এর সম্পর্ক যে লেখচিত্রের সাহায্যে প্রকাশ করা হয়, তাকে সম-আয়তনীয় লেখ বলে।
প্রশ্ন-১৫। R এর ভৌত তাৎপর্য কী?
উত্তর : 1K তাপমাত্রা বৃদ্ধির জন্য প্রতিমোল আদর্শ গ্যাস থেকে যে পরিমাণ কাজ বা শক্তি পাওয়া যায়, তার মান R-এর সমান। এটিই R এর ভৌত তাৎপর্য।
প্রশ্ন-১৬। দুর্বল ক্ষারকের অনুবন্ধী অম্ল সবল হয় কেন?
উত্তরঃ সাধারণত দুর্বল ক্ষারকের অনুবন্ধী অম্ল সবল হয়। কারণ, দুর্বল ক্ষারক প্রোটন গ্রহণ করার পর যে এসিডের সৃষ্টি হয় তার প্রোটন দান করার প্রবণতা বেড়ে যায়।
প্রশ্ন-১৭। মৃত্তিকা গঠনকারী উপাদান কি?
উত্তরঃ যেকোনো স্থানের মৃত্তিকা যে উপাদানগুলোর যুগপৎ ক্রিয়ার ফলে গঠিত হয় সে উপাদানগুলোই মৃত্তিকা গঠনকারী উপাদান। এগুলো হলো– ১. খনিজ পদার্থ (৪৫%) Al, Ca, Mg, Fe, Si, K, Na ইত্যাদি; ২. পানি (২৫%); ৩. বায়ু (২৫%); ৪. জৈব পদার্থ (৫%)।
প্রশ্ন-১৮। জ্বালানি হিসেবে প্রাকৃতিক গ্যাসের সুবিধা কি কি?
উত্তরঃ জ্বালানি হিসেবে প্রাকৃতিক গ্যাসের সুবিধাগুলো হলো–
- প্রাকৃতিক গ্যাস জ্বালানি হিসেবে সাশ্রয়ী।
- এটি পরিবেশের জন্য কম ক্ষতিকর।
- রান্নাবান্নার কাজে এ গ্যাসের ব্যবহার অন্যান্য গ্যাসের তুলনায় স্বাচ্ছন্দ্যপূর্ণ।
প্রশ্ন-১৯। সমস্যাযুক্ত মাটি কাকে বলে? বাংলাদেশে কত ধরনের সমস্যাযুক্ত মাটি পাওয়া যায়?
উত্তরঃ মাটির pH ৬.৫ এর কম বা ৭ এর বেশি হলে অথবা অতিরিক্ত লবণ মাটিতে থাকলে সে মাটিকে সমস্যাযুক্ত মাটি বলে। বাংলাদেশে সাধারণত তিন ধরনের সমস্যাযুক্ত মাটি পাওয়া যায়। যথা : ১. অম্লীয় মাটি, ২. ক্ষারীয় মাটি এবং ৩. লবণাক্ত মাটি।
প্রশ্ন-২০। ক্লোরোসিস কাকে বলে?
উত্তরঃ বায়ুমণ্ডলে দূষকরূপে SO2 এর উপস্থিতিতে উদ্ভিদের পাতার ক্লোরোফিল উৎপাদন-প্রক্রিয়া মন্দীভূত হওয়া এবং পাতার সবুজ রং লুপ্ত হওয়ার ঘটনাকে ক্লোরোসিস (Chlorosis) বলে।
প্রশ্ন-২১। বাংলাদেশে খাবার পানিতে আর্সেনিকের সর্বোচ্চ সহনীয় মাত্রা কত ppm?
উত্তরঃ বাংলাদেশে খাবার পানিতে আর্সেনিকের সর্বোচ্চ সহনীয় মাত্রা 0.05 ppm।
প্রশ্ন-২২। BOD5 কী?
উত্তরঃ পরীক্ষাগারে BOD5 নির্ণয় প্রক্রিয়াটি 5 দিন ব্যাপী সম্পন্ন করা হলে তা BOD5 লিখে প্রকাশ করা হয়।
প্রশ্ন-২৩। BOD কাকে বলে?
উত্তরঃ জৈব পদার্থের ভাঙনের প্রাক্কালে জৈব রাসায়নিক বিক্রিয়ায় ব্যবহৃত পানিতে বিদ্যমান দ্রবীভূত অক্সিজেনের পরিমাণকে BOD বলে।
প্রশ্ন-২৪। উদ্বায়ী জৈব যৌগ কাকে বলে?
উত্তরঃ সমষ্টিগতভাবে সহজে বাম্পায়নযোগ্য কার্বন এবং এদের উপজাতসমূহকে উদ্বায়ী জৈব যৌগ বলে।
প্রশ্ন-২৫। বায়োডিগ্রেডেবল দূষক কাকে বলে?
উত্তরঃ যেসব দূষক ব্যাকটেরিয়া বা জীবাণু দ্বারা বিশ্লিষ্ট হয়ে যায়, তাদের বায়োডিগ্রেডেবল দূষক বলে। যেমন– গৃহস্থালির আবর্জনা, গোবর ইত্যাদি।
প্রশ্ন-২৬। নন বায়োডিগ্রেডেবল দূষক কাকে বলে?
উত্তরঃ যেসব দূষক, ব্যাকটেরিয়া বা জীবাণু দ্বারা বিশ্লিষ্ট হয় না অথবা অত্যন্ত মন্থর গতিতে বিশ্লিষ্ট হয় সেগুলিকে নন বায়োডিগ্রেডেবল দূষক বলে। যেমন— পারদ, ডিডিটি, গ্যামাক্সিন, অলড্রিন ইত্যাদি। এগুলো পরিবেশে অতি সামান্য পরিমাণে থাকলেও মানুষ এবং অন্যান্য প্রাণীর মারাত্মক ক্ষতি হয়।
প্রশ্ন-২৭। দূষকের নিরাপদ মাত্রা কাকে বলে?
উত্তরঃ পরিবেশে উপস্থিত কোনো দূষক যে নির্দিষ্ট মাত্রা (ঘনমাত্রা) অতিক্রম করলে জীবজগতের উপর বিরূপ প্রতিক্রিয়ার সৃষ্টি হয় বা জনস্বাস্থ্যের ক্ষতি হয়, সেই নির্দিষ্ট মাত্রাটিকে ঐ দূষকের নিরাপদ মাত্রা বলে। যেমন— CO ও CO2 এর নিরাপদ মাত্রা হল যথাক্রমে 40 ppm ও 5000 ppm. আবার অতি বিষাক্ত ফসজিন (COCl2) এর নিরাপদ মাত্রা হল 0.1 ppm.
প্রশ্ন-২৮। কোনো পানির নমুনায় BOD এর মান 60 বা 60 mg/L বলতে কী বোঝায়?
উত্তরঃ কোনা পানির নমুনায় BOD এর মান 60 বা 60 mg/L বলতে বোঝায় যে, ঐ পানির প্রতি লিটারে উপস্থিত জৈব পদার্থের জৈব রাসায়নিক বিয়োজনের জন্য 60 mg অক্সিজেন প্রয়োজন।
প্রশ্ন-২৯। CO2-এর সন্ধি তাপমাত্রা 31.1°C বলতে কী বোঝ?
উত্তরঃ CO2 এর সন্ধি তাপমাত্রা 31.1°C বলতে বুঝা যায় যে, 31.1°C তাপমাত্রার উপরে যথেষ্ট চাপ প্রয়োগ করেও CO2 কে তরলীভূত করা সম্ভব নয় কিন্তু 31.1°C বা তার নিচের তাপমাত্রায় প্রয়োজনীয় চাপ প্রয়োগে CO2 গ্যাসকে তরলে রূপান্তরিত করা যায়।
প্রশ্ন-৩০। আদর্শ গ্যাস সমীকরণের ২টি ব্যবহার লেখো।
উত্তরঃ আদর্শ গ্যাসের সমীকরণ হলো PV = nRT। নিম্নে আদর্শ গ্যাস সমীকরণের দুটি ব্যবহার দেওয়া হলো:
i. আদর্শ গ্যাসের মাধ্যমে গ্যাসের আণবিক ভর নির্ণয় করা যায়।
ii. আদর্শ গ্যাসের মাধ্যমে মোল সংখ্যা নির্ণয়ের মাধ্যমে গ্যাসে উপস্থিত অণুর সংখ্যা নির্ণয় করা হয়।
প্রশ্ন-২৮। সাধারণ পানি ও ভারী পানির পার্থক্য কি?
উত্তরঃ দুই পরমাণু হাইড্রোজেন ও এক পরমাণু অক্সিজেনের সমন্বয়ে গঠিত পানি হলো সাধারণ পানি (H2O)। আর দুই পরমাণু ভারী হাইড্রোজেন বা ডিউটেরিয়াম (D2) এবং এক পরমাণু অক্সিজেনের সমন্বয়ে গঠিত পানি হলো ভারী পানি (D2O)।
সাধারণ পানির ঘনত্বের চেয়ে ভারী পানির ঘনত্ব বেশি। ভারী পানি পারমাণবিক চুল্লিতে মডারেটর হিসাবে ব্যবহৃত হয়।
প্রশ্ন-২৯। ডাল্টনের আংশিক চাপ সূত্রটি লেখো।
উত্তরঃ কোনো নির্দিষ্ট উষ্ণতায় পরস্পর বিক্রিয়াহীন দুই বা ততোধিক গ্যাসের একটি মিশ্রণের মোট চাপ মিশ্রণে উপস্থিত উপাদান গ্যাসসমূহের আংশিক চাপের সমষ্টির সমান।
প্রশ্ন-৩০। CO2 দাহ্য নয় কেন?
উত্তরঃ CO2 এ কার্বনের সর্বোচ্চ জারণ মান (+4)। ফলে CO2-এ কার্বনের জারণ মান বৃদ্ধির কোনো সুযোগ নেই। অর্থাৎ এটি বায়ুর অক্সিজেন দ্বারা জারিত হয় না। তাই CO2 দাহ্য নয়।
প্রশ্ন-৩১। চারকোল কী থেকে তৈরি করা হয়?
উত্তরঃ বিশেষ চুল্লির মাধ্যমে পাটখড়ি পোড়ালে ছাই তৈরি হয়, যা থেকে চারকোল তৈরি করা হয়। ২০১১ সালে নিবন্ধন নিয়ে প্রথম চীনা নাগরিক ওয়াংফেই বাংলাদেশে এ বিকল্প জ্বালানি চারকোলের কারখানা স্থাপন করেন এবং ২০১২ সালে প্রথম চীনে এটা রপ্তানি করা হয়।
প্রশ্ন-৩২। একটি টিউবওয়েলের পানির খরতা 200 ppm বলতে কী বোঝ?
উত্তরঃ একটি টিউবওয়েলের পানির খরতা 200 ppm বলতে বোঝায় ওজন হিসেবে টিউটবওয়েলের পানির দশ লক্ষ ভাগে যে পরিমাণ খরতা সৃষ্টিকারী পদার্থ (যেমন— Ca, Mg, Fe-এর লবণ) উপস্থিত থাকে তা 200 ভাগ CaCO3 এর সমান। অর্থাৎ টিউবওয়েলের পানির নমুনার প্রতি লিটারে 200 mg CaCO3 এর তুল্য পরিমাণ খরতা সৃষ্টিকারী লবণসমূহ উপস্থিত রয়েছে।
# বহুনির্বাচনী প্রশ্ন
17°C তাপমাত্রায় 105 kPa চাপে 0.60 L H2 গ্যাস পানির ওপর সংগ্রহ করা হলো। 17°C এ জলীয় বাষ্পের চাপ 3.25 kPa হয়।

পৃথিবীকে বেষ্ঠন করে যে বিভিন্ন রকম গ্যাসের অবস্থান লক্ষ্য করা যায়, তাকেই বায়ুমণ্ডল বলে। এই গ্যাস গুলি পৃথিবীর মাধ্যাকর্ষন শক্তির দ্বারা পৃথিবীর উপর স্তর সৃষ্টির মাধ্যমে অবস্থান করে পৃথিবীর বায়ুমণ্ডল গঠন করেছে। এই বায়ুমণ্ডল সূর্য থেকে আগত অতিবেগুনি রশ্মি শোষণ করে, তাপ শোষণের মাধ্যমে ভূপৃষ্ঠ কে উত্তপ্ত করে ও দৈনিক উষ্ণতার প্রসরকে হ্রাসের মাধ্যমে পৃথিবীকে প্রানধারনের উপযুক্ত করে তুলেছে। সমুদ্রপৃষ্ঠ থেকে বায়ুমণ্ডলের উচ্চতা প্রায় ১৬ থেকে ২৯ কিলোমিটার। বায়ুমণ্ডলীয় বিভিন্ন গ্যাস তথা বায়ুমণ্ডলের গঠনগত উপাদান এবং বিভিন্ন উচ্চতায় এই উপাদান গুলির অবস্থানের উপর ভিত্তিকে করে বিভক্ত বিভিন্ন বায়ুমণ্ডলীয় স্তর গুলি সম্পর্কে আলোচনা করা হল। এটি অনুমান করা হয় পৃথিবী বায়ুমণ্ডলের প্রায় ৯৭% সমুদ্র পৃষ্ঠ থেকে ২৯ কিলোমিটারের মধ্যে অবস্থিত।
বায়ুমণ্ডলের উপাদান সমূহ –
পৃথিবীর বায়ুমণ্ডল মূলত তিন ধরণের উপাদানের সমন্বয়ে গঠিত – ১. বিভিন্ন রকমের গ্যাস ২. জলীয় বাষ্প ৩. ধূলিকনা
১. গ্যাসীয় উপাদান – বায়ুমণ্ডলে বিভিন্ন ধরণের গ্যাসের সমন্বয়ে গঠিত । যেমন – নাইট্রোজেন (৭৮%), অক্সিজেন (২১%) বায়ুমণ্ডলের প্রধান গ্যাস যা মোট গ্যাসের প্রায় ৯৯% দখল করে আছে। বাকি ১% অধিকার করে আছে আর্গন (০.৯৩%), কার্বন-ডাই-অক্সাইড (০.০৩%), নিয়ন (০.০০১৮%), হিলিয়াম, ওজোন, হাইড্রোজেন, মিথেন প্রভৃতি।
ক. অক্সিজেন – জীবজগতের বেঁচে থাকার জন্য অক্সিজেন অপরিহার্য কারণ জীব তাদের শ্বাসকার্যের জন্য বায়ুমণ্ডলের অক্সিজেন গ্রহন করে। অক্সিজেন ছাড়া জীব জগতের বেঁচে থাকা সম্ভব হত না।
খ. নাইট্রোজেন – বায়ুমণ্ডলের অপর একটি গুরুত্বপূর্ন গ্যাস হল নাইট্রোজেন যা বায়ুমণ্ডলের মোট গ্যাসের প্রায় ৭৮% দখল করে আছে। নাইট্রোজেন উদ্ভিদ ও প্রানীর কোশের গঠনে গুরুত্বপূর্ন ভূমিকা পালন করে।
গ. কার্বন ডাই অক্সাইড – বায়ুমণ্ডলের তৃতীয় গুরুত্বপূর্ন গ্যাস কার্বন ডাই অক্সাইড যা বায়ুমণ্ডলের শুষ্ক গ্যাসের মাত্র ০.০৩% দখল করে আছে। সবুজ উদ্ভিদ সালোকসংশ্লেষ প্রক্রিয়ার সময় বায়ুমণ্ডলের সময় বায়ুমণ্ডলের কার্বন ডাই অক্সাইড গ্রহন করে। কার্বন ডাই অক্সাইড পার্থিব বিকিরনের কিছু অংশ শোষণ করে বায়ুমণ্ডলের তাপমাত্রা বৃদ্ধিতে সাহায্য করে। তাই এই গ্যাস পৃথিবীর জলবায়ু নিয়ন্ত্রনে গুরুত্বপূর্ন ভূমিকা পালন করে।
ঘ. ওজোন – অপর একটি গুরুত্বপূর্ন গ্যাস হল ওজোন, যা খুব অল্প পরিমানে উদ্ধ বায়ুমণ্ডলে উপস্থিত রয়েছে। যার পরিমান মাত্র ০.০০০৫% । ওজোন গ্যাসের উপস্থিতি সবচেয়ে বেশি লক্ষ্য করা যায় ২০ থেকে ২৫ কিমি উচ্চতার মধ্যে। এই ওজোন গ্যাস সূর্য থেকে আগত অতিবেগুনি রশ্মি শোষণ করে জীবজগতকে তার ক্ষতিকারক প্রভাব থেকে রক্ষা করে।
২. জলীয় বাষ্প – বায়ুমণ্ডলের একটি পরিবর্তনশীল উপাদান হল জলীয় বাষ্প, বায়ুতে যার পরিমান অতি সামান্য। বায়ুতে উপস্থিত জলীয় বাষ্পের পরিমান শীতল শুষ্ক জলবায়ুতে মাত্র ০.০২% এবং ক্রান্তীয় আর্দ্র জলবায়ুতে ৪% মতো হয়ে থাকে।
কার্বন ডাই অক্সাইডের মতো জলীয় বাষ্পও কোন স্থানের জলবায়ু ও আবহাওয়ার পরিবর্তনে গুরুত্বপূর্ন ভূমিকা গ্রহন করে থাকে। জলীয় বাষ্প কেবলমাত্র পার্থিব বিকিরনের দীর্ঘ তরঙ্গ শোষণ করে না তা আগত সৌর বিকিরনের কিছু অংশ শোষণ করতেও সক্ষম। এই জলীয় বাষ্প মেঘ ও বৃষ্টিপাতের প্রধান উৎস।
এই জলীয় বাস্পের প্রায় ৯০% রয়েছে মাত্র ৬ কিলোমিটারের মধ্যে এবং মাত্র ১% বা তারও কম জলীয় বাষ্প ১০ কিমির উদ্ধে পাওয়া যায়।
৩. বায়ুমণ্ডলে ক্ষুদ্র কঠিন কনা বা অ্যারোসল – বায়ুতে উপস্থিত সমস্ত রকম কঠিন কনা গুলি কে অ্যারোসল বলা হয়ে থাকে। আবহবিদদের মতে এই সূক্ষ্ম কনা গুলি বায়ুমণ্ডলে গুরুত্বপূর্ন ভূমিকা পালন করে থাকে। যেমন – এই কনা গুলি সূর্য থেকে আগত তাপের কিছু অংশ শোষণ করতে যেমন সক্ষম তেমনি এই কনা গুলির দ্বারা সৌর তাপের কিছু অংশ প্রতিফলিত হয়ে আবার মহাশূন্যে ফিরে যায়। আকাশের যে নীল রঙ দেখা যায় তার মূল কারণ হচ্ছে এই ক্ষুদ্র ধূলিকনার দ্বারা সূর্যের আলোর বিচ্ছূরন। এই ধূলিকনা গুলি আকাশে মেঘ ও কুয়াশা সৃষ্টি তে গুরুত্বপূর্ন ভূমিকা পালন করে।
বায়ুমণ্ডলের স্তর বিন্যাস
তাপমাত্রা ও বায়ুর চাপের ওপর ভিত্তি করে বায়ুমণ্ডল কে মোট পাঁচটি স্তরে ভাগ করা হয়। যথা – ১. ট্রপোস্ফিয়ার ২. স্ট্র্যাটোস্ফিয়ার ৩. মেসোস্ফিয়ার ৪. থার্মোস্ফিয়ার ৫. এক্সোস্ফিয়ার
১. ট্রপোস্ফিয়ার – বায়ুমণ্ডলের সর্বনিম্ন স্তরকে ট্রপোস্ফিয়ার বলা হয় । Teisserene de Bore ট্রপোস্ফিয়ার নামকরন করেন। ট্রপোস্ফিয়ার শব্দটির অর্থ region of mixing ।
ক. ট্রপোস্ফিয়ারের গড় উচ্চতা নিরক্ষরেখার উপর ১৬ কিমি এবং মেরুর উপর ৮ কিমি।
খ. এটি একটি গুরুত্বপূর্ন স্তর কারণ এখানে সমস্ত রকম আবহাওয়াগত ঘটনা ঘটে থাকে । যেমন – বৃষ্টিপাত, ঝড়, কুয়াশা, মেঘ, বর্জ্রপাত প্রভৃতি।
গ. ট্রপোস্ফিয়ারের একটি গুরুত্বপূর্ন বৈশিষ্ট্য হল এই স্তরে উচ্চতা বৃদ্ধির সাথে সাথে তাপমাত্রা হ্রাস পায়, প্রতি হাজার মিটার উচ্চতা বৃদ্ধিতে ৬.৫ ডিগ্রি সেলসিয়াস করে। এই ঘটনাকে বলা হয় তাপমাত্রার স্বাভাবিক হ্রাস বা Normal Lapse rate ।
ঘ. ট্রপোস্ফিয়ারের উদ্ধ অংশ কে বলা হয় ট্রপোপজ। যা প্রায় ১.৫ কিমি গভীর। ট্রপোপজের উচ্চতা নিরক্ষরেখার উপর ১৭ কিমি এবং মেরুর ওপর ৯ থেকে ১০ কিমি। ট্রপোপজ কথার অর্থ হল “ সেখানে মিশ্রন বন্ধ হয়ে যায়”।
২. স্ট্র্যাটোস্ফিয়ার – ট্রপোস্ফিয়ারের ওপরের অংশকে বলা হয় স্ট্র্যাটোস্ফিয়ার। যার উচ্চতা ভূপৃষ্ঠ থেকে প্রায় ৫০ কিমি।
ক. স্ট্র্যাটোস্ফিয়ারে উচ্চতা বৃদ্ধির সাথে সাথে উষ্ণতা বাড়তে থাকে এবং ৫০ কিমি উচ্চতায় তাপমাত্রা গিয়ে পৌঁছায় শূন্য ডিগ্রি সেলসিয়াসে।
খ. স্ট্র্যাটোস্ফিয়ার তেমন কোন আবহাওয়া গত ঘটনা লক্ষ্য করা যায় না, তাই একে শান্ত মণ্ডল বলা হয়।
গ. স্ট্র্যাটোস্ফিয়ারের নিম্ন অংশে (১৫ থেকে ৩৫ কিমির মধ্যে) ওজোন গ্যাসের উপস্থিতি লক্ষ্য করা যায়, যা আমাদের সূর্যের ক্ষতিকারক অতিবেগুনি রশ্মি থেকে রক্ষা করে।
ঘ. স্ট্র্যাটোস্ফিয়ারের ওপরের অংশ কে বলা হয় স্ট্র্যাটোপজ।
৩. মেসোস্ফিয়ার - মেসোস্ফিয়ারের বিস্তৃতি ভূপৃষ্ঠ থেকে ৫০ থেকে ৮০ কিলোমিটারের মধ্যে।
ক. মেসোস্ফিয়ারে উচ্চতা বৃদ্ধির সাথে সাথে উষ্ণতা আবার কমতে থাকে।
খ. বায়ুমণ্ডলের সমস্ত স্তরের মধ্যে মেসোস্ফিয়ার সবচেয়ে শীতল। মেসোস্ফিয়ারের উদ্ধে তাপমাত্রা – ৮০ ডিগ্রি সেলসিয়াসের নেমে যায়।
৪. থার্মোস্ফিয়ার বা আয়নোস্ফিয়ার – মেসোস্ফিয়ারের পরবর্তী অংশকে থার্মোস্ফিয়ার বলা হয়। যেখানে উচ্চতা বৃদ্ধির সাথে সাথে তাপমাত্রা দ্রুত বাড়তে থাকে। এটি অনুমান করা হয় যে থার্মোস্ফিয়ারের উপরের অংশে তাপমাত্রা প্রায় ১৭০০ ডিগ্রি। এই স্তরটি বিস্তৃতি ৮০ কিমি থেকে ৬৪০ কিমি পর্যন্ত।
৫. এক্সোস্ফিয়ার – বায়ুমণ্ডলের সর্বশেষ স্তর কে বলা হয় এক্সোস্ফিয়ার। এই স্তরে হাইড্রোজেন ও হিলিয়াম গ্যাসের উপস্থিতি লক্ষ্য করা যায়।
# বহুনির্বাচনী প্রশ্ন
ঘূর্ণিঝড় ও জলোচ্ছ্বাস
জলোচ্ছ্বাস হলো সমুদ্রের জল ফুলে উঁচু হয়ে উপকূলে আঘাত হানা। এটি এক ধরনের প্রাকৃতিক দুর্যোগ। বিভিন্ন কারণে এটা হতে পারে, সাধারণত ঘূর্ণিঝড়, সুনামির কারণে জলোচ্ছ্বাসের সৃষ্টি হয়। সুনামির ক্ষেত্রে সমুদ্রের জল সর্বোচ্চ প্রায় ৬৫ মিটার উঁচু হয়ে উপকূলে আঘাত হানতে পারে।
সাধারণ তাপমাত্রায় যেসব পদার্থ বায়বীয় অবস্থায় থাকে তাদেরকে গ্যাস বলা হয়। এটি সাধারণভাবে পদার্থের একটি ত্রিমাত্রিক অবস্থা হিসেবেই গণ্য হয়। উপরন্তু এটি পদার্থের একটি ভৌত অবস্থা মাত্র, কারণ চাপ বাড়িয়ে এবং তাপমাত্রা কমিয়ে একে তরলে এবং পরবর্তিতে কঠিনেও পরিণত করা যায়।[১] গ্যাসের উদাহরণ হল :- H2, N2, O2, CO2 ইত্যাদি।
বৈশিষ্ট্য-
- গ্যাসের ঘনত্ব কম এবং সংকোচন ক্ষমতা (Compressibility) উচ্চ। এ কারণে গ্যাসকে অল্প চাপ প্রয়োগের মাধ্যমেই অনেক সংকুচিত করা যায়।
- গ্যাসের সম্প্রসারণ ক্ষমতা (Expansibility) খুবই বেশি। যেকোন পাত্রে গ্যাস রাখলে তা অতি দ্রুত সমস্ত পাত্রে ছড়িয়ে পড়ে।
- গ্যাসের ব্যাপন ক্ষমতা অত্যধিক। দুই বা ততোধিক গ্যাস পরস্পরের মধ্যে অতি দ্রুত পরিব্যপ্ত হয়ে সমসত্ত্ব মিশ্রণ তৈরি করে।
- সকল গ্যাসই সেটিকে যে পাত্রে রাখা হয় তার দেয়ালে সমানভাবে চাপ প্রয়োগ করে।
- কঠিন ও তরল পদার্থের তুলনায় গ্যাসের আপেক্ষিক আয়তন অনেক বেশি। গ্যাসের অণুগুলোর মধ্যে আন্তঃআণবিক স্থান যথেষ্ট বেশি থাকে এবং এদের অণুগুলোর মধ্যেকার আন্তঃআণবিক বল নেই বললেই চলে।
# বহুনির্বাচনী প্রশ্ন
গ্যাসের মোল সংখ্যা (n), আয়তন (V), চাপ (P) ও তাপমাত্রা (T), এদের মাঝে যে কোনো দুটি রাশিকে স্থির রেখে অপর দুটির উপর পরীক্ষা-নিরীক্ষা করে বিজ্ঞানীরা গ্যাসের ভৌত ধর্মভিত্তিক বিভিন্ন সূত্র আবিষ্কার করেন। এ সূত্র গুলো গ্যাসসূত্র নামে পরিচিত। এরা হচ্ছে-
বয়েলের সূত্র : যা স্থির তাপমাত্রায় গ্যাসের আয়তনের উপর চাপের প্রভাব প্রকাশ করে।
চার্লসের বা গে লুস্যাকের সূত্র : যা গ্যাসের আয়তনের উপর তাপমাত্রার প্রভাব প্রকাশ করে।
অ্যাভোগাড্রোর সূত্র : যা গ্যাসের অণুর সংখ্যা ও মোলার আয়তনের মধ্যে সম্পর্ক নিয়ে তথ্য প্রকাশ করে।
এছাড়া কেবল মিশ্র গ্যাসের জন্য আরো দুটি গুরুত্বপূর্ণ সূত্র রয়েছে। যেমন-
ডালটনের আংশিক চাপ সূত্র : যা গ্যাস মিশ্রণের মোট চাপ এবং মিশ্রণে থাকা উপাদান গ্যাসের আংশিক চাপের মধ্যে সম্পর্ক প্রকাশ করে।
গ্রাহামের ব্যাপন সূত্র : যা গ্যাসের ঘনত্ব ও ব্যাপন হার সম্পর্কে তথ্য প্রকাশ করে।
প্রতিটা সূত্র থেকে আমরা কিছু নির্দিষ্ট সমীকরণ, সূত্রকে মেনে চলে এমন গ্রাফ, প্রতিটা গ্রাফের বিভিন্ন অবস্থা এসব নিয়ে পরের লেখা গুলোতে আলোচনা করবো।
# বহুনির্বাচনী প্রশ্ন
22.4
44.8
67.2
69.6
গ্যাসের আয়তন, চাপ ও তাপমাত্রার একক
১. আয়তনের একক:
- গ্যাসের পরিমাপের জন্য আয়তন একটি গুরুত্বপূর্ণ বৈশিষ্ট্য।
- সাধারণত ব্যবহৃত একক:
- লিটার (L): গ্যাসের আয়তন প্রকাশের একটি প্রচলিত একক।
- মিলিলিটার (mL): 1 L = 1000 mL।
- কিউবিক মিটার (m³): বৃহৎ আয়তনের জন্য ব্যবহৃত, 1 m³ = 1000 L।
- কিউবিক সেন্টিমিটার (cm³): ছোট আকারে পরিমাপের জন্য, 1 cm³ = 1 mL।
২. চাপের একক:
- গ্যাসের চাপ বলতে বোঝানো হয় একটি পাত্রের দেওয়ালে গ্যাস কণার আঘাতের ফলাফল।
প্রচলিত একক:
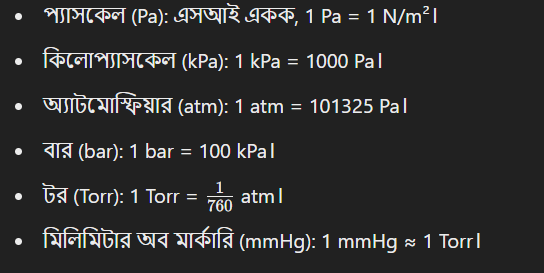
৩. তাপমাত্রার একক:
- গ্যাসের তাপমাত্রা তার কণার গতিশক্তির উপর নির্ভর করে।
- প্রচলিত একক:
- কেলভিন (K): গ্যাসের তাপমাত্রা পরিমাপের এসআই একক, এটি সর্বদা ধনাত্মক। ° C + 273.15
K =
ডিগ্রি সেলসিয়াস (°C): ব্যবহারিক ক্ষেত্রে প্রচলিত।
ডিগ্রি ফারেনহাইট (°F): কিছু ক্ষেত্রে ব্যবহৃত। ° F = 9/5 deg * C + 32
সম্পর্ক:
গ্যাসের ত্রৈমাত্রিক বৈশিষ্ট্য (আয়তন, চাপ এবং তাপমাত্রা) গ্যাসের অবস্থার সমীকরণ দ্বারা সংজ্ঞায়িত হয়:PV = nRT
এখানে, P চাপ, V আয়তন, T তাপমাত্রা, n গ্যাসের মোল সংখ্যা, এবং R গ্যাস ধ্রুবক।
গুরুত্বপূর্ণ নোট:
- তাপমাত্রা সবসময় কেলভিনে প্রকাশ করতে হবে।
- চাপ ও আয়তনের একক সামঞ্জস্যপূর্ণ হতে হবে।
# বহুনির্বাচনী প্রশ্ন
1662 খ্রিষ্টাব্দে বিজ্ঞানী রবার্ট বয়েল স্থির উষ্ণতায় গ্যাসের চাপ ও আয়তনের পারস্পরিক সম্পর্ক যুক্ত একটি সূত্রের অবতারণা করেন। এই সুত্রটিকে বয়েলের সূত্র বলে।
বয়েলের সূত্র-
স্থির উষ্ণতায়, নির্দিষ্ট ভরের যে কোনো গ্যাসের আয়তন ওই গ্যাসের চাপের সঙ্গে ব্যস্তানুপাতে পরিবর্তিত হয়।
বয়েলের সূত্রের গাণিতিক রূপ-
মনে করি, নির্দিষ্ট উষ্ণতায় নির্দিষ্ট ভরের কোন গ্যাসের আয়তন V এবং চাপ P; তাহলে বয়েলের সূত্র অনুসারে, V α 1/P, যখন উষ্ণতা T স্থির। অতএব, V = K/P, যেখানে K একটি ধ্রুবক। অর্থাৎ, PV= ধ্রুবক, যখন উষ্ণতা T স্থির। এটি বয়েলের সূত্রের গাণিতিক রূপ।
এখন যদি উষ্ণতায় নির্দিষ্ট ভরের কোন গ্যাসের P1 চাপে আয়তন V1 এবং P2 চাপে আয়তন V2 হয়, তবে বয়েলের সূত্র অনুসারে, P1V1 = P2V2 = K (ধ্রুবক) হয়।
সুতরাং, বয়েলের সূত্র থেকে বলা যায় যে, স্থির উষ্ণতায় নির্দিষ্ট ভরের কোন গ্যাসের ক্ষেত্রে গ্যাসের আয়তন এবং চাপের গুণফল সর্বদা ধ্রুবক। অর্থাৎ, গ্যাসের চাপ বাড়ালে আয়তন কমে এবং চাপ কমালে আয়তন বাড়ে।
বয়েলের সূত্রের ধ্রুবক দুটি হল: (1) গ্যাসের ভর এবং (2) গ্যাসের ধর্ম।
# বহুনির্বাচনী প্রশ্ন
1787 খ্রিস্টাব্দে ফরাসি বিজ্ঞানী জাক আলেকসান্দ্রা সেজার চার্লস (Jacques Alexandre Cesar Charles ), স্থির চাপে, কোনো নির্দিষ্ট ভরের গ্যাসের উষ্ণতা বৃদ্ধির সঙ্গে আয়তন প্রসারণের সম্পর্ক পরীক্ষা করে দেখেন। তিনি এই সিদ্ধান্তে আসেন যে, স্থির চাপে, কোনো নির্দিষ্ট আয়তনের যে – কোনো গ্যাস সমান উষ্ণতা বৃদ্ধিতে সমপরিমাণে প্রসারিত হয়। 1802 খ্রিস্টাব্দে গে লুসাক (Gay Lussac) প্রায় - একই সিদ্ধান্তে উপনীত হন। তিনি দেখান যে স্থির চাপে সকল গ্যাসের আয়তন প্রসারণ গুণাঙ্ক সমান। 1842 খ্রিস্টাব্দে বিজ্ঞানী আরি ভিক্টর রেনো (Henri Victor Regnault) পরীক্ষা করে দেখান যে এই গুণাঙ্কের মান প্রতি ডিগ্রি সেলসিয়াসে 273। গে লুসাক ও রেনোর পরীক্ষালব্ধ ফলের সমন্বয় ঘটিয়ে চার্লসের সূত্রটি প্রকাশ করা হয়।
চার্লসের সূত্র – স্থির চাপে, কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন প্রতি ডিগ্রি সেলসিয়াস উন্নতা বৃদ্ধি বা হ্রাসের জন্য ওই গ্যাসের 0°C- এর আয়তনের 1/273 অংশ বৃদ্ধি বা হ্রাস পায়
চার্লসের সূত্রের গাণিতিক রূপ
ধরা যাক, স্থির চাপে ° C উন্নতায় কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন Vol
চার্লসের সূত্রানুযায়ী,°C উষ্ণতায় ওই গ্যাসের আয়তন, V1 = (Vo+Vo×1/273)
2°C উষ্ণতায় ওই গ্যাসের আয়তন, V2=(Vo+Vo×2/273)
t°C উষ্ণতায় ওই গ্যাসের আয়তন,
Vt= (Vo+Voxt/273) বা
Vt= Vo(1+t/273)
অনুরূপে t°C উষ্ণতা হ্রাস, অর্থাৎ -t°C উষ্ণতায়, ওই গ্যাসের আয়তন, Vt = Vo (1-t/273) সুতরাং স্থির চাপে কোনো নির্দিষ্ট ভরের গ্যাসের আয়তন উষ্ণতার সঙ্গে রৈখিকভাবে (linearly) পরিবর্তিত হয়।
গ্যাসের আয়তন ও উষ্ণতার পরম স্কেলের সম্পর্ক
ধরা যাক, স্থির চাপে কোনো নির্দিষ্ট ভরের গ্যাসের ০°C উষ্ণতায় আয়তন Vo, t1°C উষ্ণতায় আয়তন V1 এবং t2°C উষ্ণতায় আয়তন
V21
চার্লসের সূত্রানুসারে,V = Vo (1+ t1/273)
V1= Vo{(273+t1)/273}
V1= Vo×T1/273 [ যেখানে T1= (273 + t1) ]
স্পষ্টতই সেলসিয়াস স্কেলের t1°C উষ্ণতা এবং পরম স্কেলের TIK উন্নতা অভিন্ন
অনুরূপ ভাবে, V2=Vo×T2/273
উপরোক্ত সমীকরণ থেকে পাই –
V1/V2=T1/T2
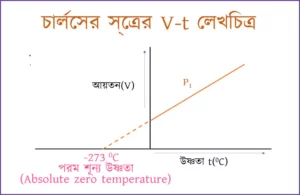
পরমশূন্য উষ্ণতা বা পরমশূন্য তাপমাত্রা কাকে বলে?
পরমশূন্য উষ্ণতা ( Absolute zero temperature ) : কোনো গ্যাসকে - 273°C উষ্ণতা পর্যন্ত শীতল করা সম্ভব হলে গ্যাসটির আয়তন ও চাপের মান তাত্ত্বিকভাবে শূন্য হয়ে যায় এবং গ্যাসের অণুগুলির গতিশক্তির মানও শূন্য হয়। এই বিশেষ ঊয়তাটিকে পরমশূন্য
বা চরমশূন্য উয়তা বলে। এর মান 273°C বা OK
চার্লসের সূত্র থেকে পরমশূন্য তাপমাত্রার ধারণা
চার্লসের সূত্রানুযায়ী আমরা জানি, স্থির চাপে প্রতি 1°C উয়তা বৃদ্ধি বা হ্রাসের জন্য নির্দিষ্ট ভরের গ্যাসের আয়তন, 0°C উষ্ণতায় ওই গ্যাসের যা আয়তন হয় তার 1/273 অংশ বৃদ্ধি বা হ্রাস পায়।
ধরি, স্থির চাপে নির্দিষ্ট ভরের গ্যাসের O°C উষ্ণতায় আয়তন Vo 3 t° C উয়তায় আয়তন Vt,
চার্লসের সূত্রানুযায়ী, Vt= Vo ( 1 + t/273)
চাপ স্থির রেখে উষ্ণতা কমিয়ে - 273°C- এ আনলে চার্লসের সূত্রানুযায়ী, -273°C উয়তায় ওই গ্যাসের আয়তন হবে
V=Vo(1+-273/273) =} V=0
# বহুনির্বাচনী প্রশ্ন
১৮১১ খ্রিস্টাব্দে ইতালীয় পদার্থবিজ্ঞানী অ্যাভোগাড্রো গ্যাসের আয়তন ও অণুর সম্পর্কীয় একটি সূত্র প্রস্তাব করেন। অ্যাভোগাড্রোর সূত্রটি হচ্ছে-
“স্থির তাপমাত্রায় ও স্থির চাপে সমআয়তনের মৌলিক ও যৌগিক সকল গ্যাসে সমসংখ্যক অণু থাকে।”
এ সূত্র থেকে পরীক্ষা দ্বারা সহজেই প্রমাণ করা যায় যে, স্থির তাপমাত্রায় ও চাপে সকল গ্যাসেরই মোলার আয়তন সমান এবং প্রমাণ তাপমাত্রায় ও চাপে তার পরিমাণ হচ্ছে 22.4 Litter। অ্যাভোগাড্রোর সূত্র মতে পাওয়া যায়, স্থির তাপমাত্রায় ও চাপে কোন গ্যাসের আয়তন এর মোল সংখ্যার সমানুপাতিক হয়। এই সূত্রানুযায়ী-
Van (যখন গ্যাসের চাপ ও তাপমাত্রা স্থির)
এখানে n = গ্যাসের মোল সংখ্যা এবং V = n মোল যুক্ত ঐ গ্যাসের আয়তন।
অ্যাভোগাড্রো সংখ্যা
অ্যাভোগাড্রো সূত্র অনুযায়ী একই তাপমাত্রায় ও চাপে সমআয়তনের সকল গ্যাসে সমান সংখ্যক অণু থাকে। আবার একই তাপমাত্রায় ও চাপে সকল গ্যাসেরই মোলার আয়তন সমান। এ দুটি সূত্র ও সিদ্ধান্তকে সংযুক্ত করে বলা যায়-
একই তাপমাত্রায় ও চাপে যেকোনো গ্যাসের 1 মোলে সমান সংখ্যক অণু থাকে। যেহেতু তাপমাত্রা ও চাপের হ্রাস বৃদ্ধিতে অণুর সংখ্যা বাড়ে না বা কমে না, সেহেতু সকল গ্যাসের মোল (mole) পরিমাণে সমান সংখ্যক অণু থাকে। এ সকল গ্যাসকে শীতল করলে তারা প্রথমে তরল এবং পরে কঠিন পদার্থে পরিণত হবে, কিন্তু অণুর সংখ্যা কমবে-বাড়বে না। সুতরাং সকল পদার্থের (কঠিন, তরল বা গ্যাসীয়) এক মোল পরিমাণে নির্দিষ্ট সংখ্যক অণু থাকে, এ সংখ্যাকে অ্যাভোগাড্রো সংখ্যা বলা হয়। এ সংখ্যাকে 'N' দ্বারা প্রকাশ করা হয়। এটি একটি ধ্রুবক সংখ্যা, তাই N কে অ্যাভোগাড্রো ধ্রুবক-ও বলা হয়।
বিভিন্ন পরীক্ষা দ্বারা এর মান বের করা হয়েছে 6.022 × 1023। অর্থাৎ-
NA 1 = 6.022 × 1023 অণু প্রতি মোল (Atom mol-1)
মনে রাখতে হবে, n দিয়ে সাধারণত কোনো পদার্থের মোল সংখ্যাকে প্রকাশ করা হয়। আবার কোনো নমুনায় উপস্থিত মোট অণুর সংখ্যাকে N দ্বারা প্রকাশ করা হয়। অ্যাভোগাড্রো সংখ্যাকে NA দ্বারা প্রকাশ করা হয় এবং নমুনা পদার্থের পরিমাণ এক মোল হলে তখন N = NA হয়। তাই বিভ্রান্তি দূর করার জন্য এখানে NA এবং N এর মধ্যে সম্পর্ক দেখানো হল, N = NA xn
# বহুনির্বাচনী প্রশ্ন
বয়েলের সূত্র ও চার্লসের সূত্রের সমন্বয় করার ক্ষেত্রে বয়েলের সূত্র অনুসারে স্থির তাপমাত্রায় নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন ঐ গ্যাসের উপর যে চাপ কাজ করে
তার ব্যস্তানুপাতিক।
আবার চার্লসের সূত্র অনুসারে, স্থির চাপে নির্দিষ্ট ভরের কোনো গ্যাসের আয়তন তার কেলভিন তাপমাত্রা বা পরম তাপমাত্রার সমানুপাতিক। এবার আমরা বয়েলের সূত্র ও চার্লসের সূত্রের সমন্বয় বের করবো।
এখন নির্দিষ্ট ভরের কোন গ্যাসের আয়তন VI, চাপ P1 এবং কেলভিন তাপমাত্রা T1 হলে বয়েলের সূত্র মতে-
V1 x 1/P1 (যখন তাপমাত্রা T স্থির থাকে)
চার্লসের সূত্র মতে,
V1 x T1 (যখন চাপ P স্থির থাকে)
এই দুটো সূত্রকে একসাথে আমরা লিখতে পারি-
V1 x P1 / T1 (যখন T ও P উভয় পরিবর্তিত হয়)
or, V1 = kP1 / T1 (এক্ষেত্রে K একটি আনুপাতিক ধ্রুবক)
or, k = P1V1 / T1
আবার ঐ একই পরিমাণ গ্যাসের চাপ পরিবর্তিত হয়ে P2. তাপমাত্রা পরিবর্তিত হয়ে T2 এবং আয়তন পরিবর্তিত হয়ে V3 হলে অনুরূপভাবে আমরা পাই-
k = P2V2 / T2
তাহলে লিখা যায়-
P1V1 / T1 = P2V2 / T2 = k (ধ্রুবক)
অর্থাৎ সাধারণভাবে, PV = KT লিখা যায় যার মানে অর্থাৎ PV - • T। এখানে বয়েলের সূত্র ও চার্লসের সূত্র-এ দুটি গ্যাস সূত্রকে সমন্বয় করা হয়েছে বলে PV = KT সমীকরণটিকে গ্যাসের সমন্বয় সূত্রের সমীকরণ বলা হয়। এ সমীকরণটি নির্দিষ্ট পরিমাণ গ্যাসের চাপ, আয়তন ও পরম তাপমাত্রার মধ্যে সম্পর্ক প্রকাশ করে।
এবার আরেকটা বিষয় নিয়ে বলবো। স্থির তাপমাত্রায় বয়েলের সূত্র মতে গ্যাসের আয়তন এর ঘনত্বের বিপরীত অনুপাতে পরিবর্তিত হয়। অর্থাৎ V1 আয়তনের গ্যাসের
ঘনত্বকে d1 দিয়ে প্রকাশ করলে-
V1 x 1/d1
or, V1 = k/d1
or, k = V1d1
একইভাবে V2 আয়তন যুক্ত গ্যাসের জন্য ঘনত্ব d2 হলে-
V2 = k/d2
or, V2d2 = k
তাহলে আমরা বলতে পারি-
V1/V2= d2/d1
এবার বয়েল-চালসের সমন্বয় সূত্র হতে দেখি-
P1V1/T1 = P2V2/T2
or, V1/V2 = P2T1/P1T2
or, d2/d1 = P2T1/P1T2
or, d1T1 / P1 = d2T2 / P2
এটাই বয়েলের সূত্র ও চার্লসের সূত্রের সমন্বয়।
# বহুনির্বাচনী প্রশ্ন
একই পরিমাণের বিভিন্ন গ্যাস একই আয়তনের বিভিন্ন পাত্রে একই তাপমাত্রায় রেখে যদি চাপ পরিমাপ করা হয় তাহলে প্রত্যেকের চাপ প্রায় সমান পাওয়া যায়। তাপমাত্রা আরো বাড়িয়ে যদি আবার চাপ পরিমাপ করা হয় তাহলে গ্যাসগুলোর চাপের মান আরো কাছাকাছি পাওয়া যায়। তাপমাত্রা যত বাড়ানো যাবে চাপের পার্থক্য ততই কমতে থাকবে।
তাপমাত্রা আরো বাড়িয়ে চাপ পরিমাপ করতে থাকলে একসময় দেখা যাবে প্রত্যেকটি গ্যাসই pV=nRT সমীকরণ মেনে চলছে। এখানে p= গ্যাসের চাপ, V= গ্যাসের আয়তন, n= গ্যাসের মোল সংখ্যা, R= সার্বজনীন গ্যাস ধ্রুবক, প্রত্যেক গ্যাসের জন্যে যার মান 8.31Jmol−1K1 এবং T= কেলভিন এককে গ্যাসের তাপমাত্রা। এ সমীকরণকে বলা হয় আদর্শ গ্যাস সমীকরণ।
যে সকল গ্যাস সকল তাপমাত্রা ও চাপে এই সমীকরণ মেনে চলে তারাই আদর্শ গ্যাস। প্রকৃতিতে অবশ্য এমন কোনো গ্যাসের অস্তিত্ব নেই যা প্রকৃতপক্ষে আদর্শ। উচ্চতাপমাত্রা ও নিম্নচাপে সকল গ্যাসই আদর্শ গ্যাসের ন্যায় আচরণ করে।
আদর্শ গ্যাস সমীকরনের বিভিন্ন ব্যবহার-
কোনো গ্যাসের আণবিক ভর M হলে W গ্রাম ভরের সেই গ্যাসের মোল সংখ্যা n = W/M। আবার W গ্রাম ভরের কোন গ্যাসের আয়তন V হলে, তার ঘনত্ব d = W/V। সুতরাং PV=nRT এ আদর্শ গ্যাস সমীকরণকে বিভিন্নভাবে প্রকাশ করা যায়। যেমন-
P1V1 / T1 = P2V2 / T2 (যে কোন পরিমাণ গ্যাসের ক্ষেত্রে)
PV = nRT (যে কোন পরিমাণ (n মোল) গ্যাসের ক্ষেত্রে)
PVm = RT (যখন n=1 অর্থাৎ এক মোল পরিমাণ গ্যাসের ক্ষেত্রে)
PV = WRT / M (M আণবিক ভর বিশিষ্ট w গ্রাম পরিমাণ গ্যাসের ক্ষেত্রে)
M = WRT / VP (d ঘনত্ব বিশিষ্ট গ্যাসের ক্ষেত্রে প্রযোজ্য)
= dRT / P
মনে রাখা প্রয়োজন গ্যাসের এ সকল সমীকরণে চাপ ও আয়তনের পরিমাণ বিভিন্ন এককে প্রকাশ করা যায়, কিন্তু তাপমাত্রা T-কে সবসময় পরম তাপমাত্রা স্কেলে
প্রকাশ করতে হবে।
আদর্শ গ্যাস সমীকরণের ব্যবহার
আদর্শ গ্যাস সমীকরণ PV=nRT ব্যবহার করার মাধ্যমে-
(১) গ্যাসের আণবিক ভর ও
(২) গ্যাসের ঘনত্ব নির্ণয় করা যায়।
গ্যাসের আণবিক ভর নির্ণয়: আদর্শ গ্যাস সমীকরণের সাহায্যে গ্যাস ও উদ্বায়ী তরলের আণবিক ভর নির্ণয় করা যায়। কোন গ্যাসের আণবিক ভর M হলে এর মোলার ভর হবে M গ্রাম। তখন w গ্রাম ভরের সে গ্যাসের মোল সংখ্যা n = W / MI এখন আদর্শ গ্যাস সমীকরণকে নিম্নরূপ লেখা যায়-
PV = nRT
= WRT / M
অতএব, M= WRT / PV
এ সম্পর্ক হতে দেখা যায় যে, যদি কোন নির্দিষ্ট ভরের (W) গ্যাস বা বাষ্পের আয়তন (V)-কে নির্দিষ্ট তাপমাত্রা (T) ও চাপে (P) নির্ণয় করা যায়, তবে উপরিউক্ত সমীকরণ ব্যবহার করে সে গ্যাস বা উদ্বায়ী তরলের আণবিক ভর গণনার সাহায্যে নির্ণয় করা যায়। ফরাসি বিজ্ঞানী ডুমা এ মূলনীতি প্রয়োগ করে উদ্বায়ী তরলের আণবিক ভর নির্ণয়ের পদ্ধতি উদ্ভাবন করেন, যা ডুমার আণবিক ভর নির্ণয় প্রণালী নামে পরিচিত।
গ্যাসের ঘনত্ব নির্ণয় : আদর্শ গ্যাস সমীকরণের সাহায্যে গ্যাসের ঘনত্ব নির্ণয় করা যায়। কোন গ্যাসের আণবিক ভর M হলে, W গ্রাম ভরের সে গ্যাসের আয়তন v হলে, সে গ্যাসের ঘনত্ব, d = W / V হয়। এখন আদর্শ গ্যাস সমীকরণকে নিম্নরূপে লেখা যায়
PV = nRT = WRT / M
or, W/V = PM/RT
অতএব, d = PM / RT
অর্থাৎ কোন গ্যাসের আণবিক ভর (M) জানা থাকলে নির্দিষ্ট তাপমাত্রা (T) ও নির্দিষ্ট চাপে (P) ঐ গ্যাসের ঘনত্ব নির্ণয় করা যায়
# বহুনির্বাচনী প্রশ্ন
যে সব গ্যাস পরস্পরের সাথে বিক্রিয়া করে না, তারা পরস্পরের সাথে যে কোন অনুপাতে মিশ্রিত হয়ে সমসত্ত্ব মিশ্রণ তৈরি করে। পরীক্ষা-নিরীক্ষা থেকে প্রাপ্ত উপাত্তের ভিত্তিতে ১৮০২ খ্রিস্টাব্দে জন ডাল্টন স্থির তাপমাত্রায় গ্যাস মিশ্রণের উপাদানসমূহের নিজস্ব চাপের সাথে গ্যাস মিশ্রণের মোট চাপের একটি সম্পর্ক স্থাপন করেন, তা ডাল্টনের আংশিক চাপ সূত্র নামে পরিচিত। ডালটনের আংশিক চাপ সূত্রটি নিম্নরূপ-
কোন নির্দিষ্ট তাপমাত্রায় বিক্রিয়াবিহীন কোন গ্যাস মিশ্রণের কোন একটি উপাদান গ্যাস ঐ তাপমাত্রায় মিশ্রণের সমস্ত আয়তন একাকী দখল করলে যে চাপ প্রয়োগ করত, তাকে ঐ উপাদান গ্যাসের আংশিক চাপ বলা হয়। ঐ গ্যাস মিশ্রণের মোট চাপ ঐ তাপমাত্রায় তার উপাদান গ্যাসসমূহের আংশিক চাপসমূহের যোগফলের সমান।
মনে করি, একটি গ্যাস পাত্রের আয়তন V। এতে স্থির তাপমাত্রায় বিক্রিয়াবিহীন তিনটি গ্যাসের নমুনা পৃথকভাবে রাখা হলে তাদের চাপ হয় যথাক্রমে P1, P2, P3
প্রভৃতি। একই তাপমাত্রায় ঐ গ্যাস পাত্রে এসব গ্যাস একত্রে প্রবেশ করালে যে গ্যাস মিশ্রণ পাওয়া যায়, তার চাপ হচ্ছে Pm। তাহলে ডালটনের সূত্র মতে,
Pm = P1 + P2 + P3
ডালটনের আংশিক চাপ সূত্রের গাণিতিক প্রকাশ
মনে করি, V আয়তন বিশিষ্ট পাত্রে পরস্পর বিক্রিয়াবিহীন বিভিন্ন গ্যাসের যথাক্রমে 1, 12, 13 মোল আছে। নির্দিষ্ট তাপমাত্রা T তে ঐ সব গ্যাস একাকীভাবে প্রত্যেকে একই আয়তন দখল করলে তাদের চাপ যথাক্রমে P1, P2, P3 প্রভৃতি হয়। অর্থাৎ P1, P2, P3... হচ্ছে ঐ সব গ্যাসের আংশিক চাপ। অপরদিকে এ সব বিক্রিয়াবিহীন গ্যাস একত্রে একই পাত্রে থাকা অবস্থায় প্রদত্ত চাপ হচ্ছে Pm l
যেহেতু প্রথম গ্যাসের n মোল স্থির তাপমাত্রা T তে পৃথকভাবে V আয়তন দখল করে P চাপ প্রয়োগ করে,
সেহেতু আদর্শ গ্যাস সমীকরণ মতে আমরা পাই,
P1V = n₁RT
or, P1 = n,RT/V
একইভাবে দ্বিতীয়, তৃতীয় প্রভৃতি গ্যাসের জন্য পাওয়া যায়,
P2V = n2RT
or, P2 = n2RT / V
P3V = nзRT
or, P3 = n3RT / V
এ সব সমীকরণের ডান পক্ষ ও বাম পক্ষ পৃথকভাবে যোগ করে পাওয়া যাবে
P1 + P2 + P3 + ....... = RT (1 + 2 + 3 + ....... ) / v
আবার n1 + n2 + n3 + .... = n ঐ পাত্রে গ্যাসসমূহের মোট মোল সংখ্যা।
তাহলে, P1 + P2 + P3 + ..... = nRT / V -(1)
সুতরাং ঐ গ্যাস মিশ্রণের চাপ Pm হলে, আদর্শ গ্যাস সমীকরণ মতে পাওয়া যায়-
PmV = nRT
or, Pm = nRT / V -(2)
সমীকরণ (1) ও (2) হতে পাওয়া যায়,
P1P2P3 + ........ = Pm
এটিই হচ্ছে ডালটনের আংশিক চাপ সূত্রের গাণিতিক প্রকাশ।
স্থির চাপে উচ্চ ঘনত্বের স্থান হতে নিম্ন ঘনত্বের স্থানের দিকে কোনো পদার্থের (কঠিন, তরল, বায়বীয়) স্বতঃস্ফূর্তভাবে চতুর্দিকে ছড়িয়ে পড়ার নাম ব্যাপন। গ্যাসের ক্ষেত্রে যতক্ষণ সবদিকে গ্যাসের ঘনত্ব সমান না হয় ততক্ষণ ব্যাপন প্রক্রিয়া চলতে থাকে। উদাহরণ হিসাবে ফুলের সুগন্ধ ছড়ানো, পারফিউমের গন্ধ সবদিকে ছড়িয়ে পড়া ইত্যাদি।
অপরদিকে বাহ্যিক চাপের প্রভাবে সরুছিদ্র পথে কোনো গ্যাসের সজোরে বের হয়ে আসাকে নিঃসরণ বা অণু ব্যাপন বলে। উদাহরণ গাড়ির চাকার লিক দিয়ে সজোরে বায়ু বের হয়ে আসা।
1829 সালে গ্যাসের ব্যাপন পরীক্ষা করে গ্রাহাম একটি সূত্রের অবতারণা করেন যা গ্রাহামের ব্যাপন সূত্র নামে পরিচিত। গ্রাহামের ব্যাপন সূত্রটি নিম্নরূপঃ
“স্থির তাপমাত্রা ও চাপে যে কোনো গ্যাসের ব্যাপনের হার তার ঘনত্বের বর্গমূলের বিপরীত অনুপাতে পরিবর্তিত হয়।”

যেখানে:
Rate1 হলো প্রথম গ্যাসের ব্যাপন হার (একক সময়ে আয়তন বা মোলসংখ্যা)।
Rate2 হলো দ্বিতীয় গ্যাসের ব্যাপন হার।
M1 হলো প্রথম গ্যাসের মোলার ভর।
M2 হলো দ্বিতীয় গ্যাসের মোলার ভর।
গ্রাহামের ব্যাপন সূত্র বা গ্রাহামের নিঃসরণ সূত্র কোনো ছিদ্রের মধ্য দিয়ে যে কোনো সময়ে কোনো একটি গ্যাসের চলাচলকে ব্যাখ্যা করতে পারে করে। এই সূত্র গ্রাহামের উপর্যুক্ত সূত্রেরই ব্যাপ্ত রূপ। গ্রাহাম পর্যবেক্ষণ করেন যে, দুটো গ্যাসের ব্যাপনের হার এবং এদের আণবিক ভরের (Molar mass) বর্গমূলের ব্যস্তানুপাত সমান।
# বহুনির্বাচনী প্রশ্ন
গ্যাসের আচরণ ।বয়েলের সূত্র। চার্লসের সূত্র। পরম শূন্য উষ্ণতা। মাধ্যমিক ভৌতবিজ্ঞান
গ্যাসের বৈশিষ্ট্য :
1. গ্যাসের অনুগুলির মধ্যে আন্তঃআণবিক ব্যবধান বেশি।
2. গ্যাসের অনুগুলির মধ্যে আন্তঃআণবিক আকর্ষণ কম।
3. গ্যাসের অনুগুলির ছড়িয়ে পড়ার প্রবণতা থাকে।
4. গ্যাসের অনুগুলির গতিশক্তির জন্যই গ্যাসের চাপ সৃষ্টি হয়।
5. পাত্রের মধ্যে থাকা গ্যাসের আয়তন হলো আসলে ওই 6. পাত্রের আয়তন। ক্যানাডা গ্যাস সমস্ত পাত্র জুড়ে ছড়িয়ে থাকে।
চাপের একক বলতে তরল কিংবা গ্যাস উভয়ের চাপ বোঝায় কিন্তু গ্যাসের চাপ পরিমাপের অতিরিক্ত একটি একক আছে।
◾ এস আই পদ্ধতিতে : নিউটন / বর্গমিটারে
◾ সিজিএস পদ্ধতিতে ডাইন / বর্গ সেমি
গ্যাসের চাপ পরিমাপের একটি ব্যবহারিক একক হল অ্যাটমসস্ফিয়ার।
গ্যাসের চাপ পরিমাপের আরেকটি ব্যবহারিক একক হল বার।
বার ও ডাইম প্রতি বর্গ সেমি এর সম্পর্ক
1 বার = 10^6 dyn / cm^2
পারদ স্তম্ভের উচ্চতার সাথে গ্যাসের চাপের কি সম্পর্ক ?
গ্যাসের চাপ = পারদ স্তম্ভের উচ্চতা × পারদ এর ঘনত্ব × অভিকর্ষজ ত্বরণ
76 সেমি পারদ স্তম্ভের উচ্চতা বায়ুমণ্ডলের কত চাপ নির্দেশ করে
এক্ষেত্রে বায়ুমন্ডলের চাপ = 76×13.6×980 dyn / cm^2
বয়েল কে ছিলেন ?
রবার্ট বয়েল আয়ারল্যান্ডের একজন বিখ্যাত দার্শনিক, রসায়নবিদ , পদার্থবিদ এবং আবিষ্কারক ছিলেন। 'বয়েলের সূত্র' এর জন্য তিনি বিখ্যাত। রবার্ট হুক তার ই স্টুডেন্ট ছিলেন।
বয়েলের সূত্র :
" The absolute pressure exerted by a given mass of an ideal gas is inversely proportional to the volume it occupies if the temperature and amount of gas remain unchanged within a closed system"

বাংলায় বয়েলের সূত্রটি এমন হবে,
স্থির উষ্ণতায় নির্দিষ্ট ভরের গ্যাসের আয়তন ওই গ্যাসের চাপের সঙ্গে ব্যস্তানুপাতেপরিবর্তিত হয়।
◾ বয়েলের সূত্রের গাণিতিক রূপ:
P1V1=P2V2=P3V3
নির্দিষ্ট উষ্ণতায় বয়েলের সূত্রানুযায়ী P - V লেখচিত্র কেমন হবে।
নির্দিষ্ট উষ্ণতায় বয়েলের সূত্রানুযায়ী PV - P লেখচিত্র কেমন হবে।
পুকুরের তলদেশ থেকে বুদবুদ উপরে উঠে আসলে আয়তন বৃদ্ধি পায় কেন ?
পুকুরের তলদেশে উৎপন্ন বুদ বুদ হল আসলে গ্যাসীয় পদার্থ।পুকুরের তলদেশের গভীরতা বেশি তাই সেখানে জলের চাপ ও বেশি।বুদবুদ উপরে উঠে আসলে জলের চাপ কমে তাই বয়েলের সূত্র অনুযায়ী গ্যাসের আয়তন বৃদ্ধি পায় অর্থাৎ এক্ষেত্রে বুদবুদ এর আয়তন বৃদ্ধি পাবে।
আলেক্সান্ড্রে চার্লস কে ছিলেন?
চার্লস ছিলেন একজন ফ্রান্সের আবিষ্কারক বিজ্ঞানী গণিতবিদ ও বেলুন বিদ। "চার্লসের সূত্র" এর জন্য তিনি বিখ্যাত।
# বহুনির্বাচনী প্রশ্ন
চার্লসের সূত্র:
বাংলায় চার্লসের সূত্র এমন হবে:
নির্দিষ্ট চাপে প্রতি ডিগ্রী সেলসিয়াস উষ্ণতা বৃদ্ধি বা হ্রাসের জন্য কোন নির্দিষ্ট ভরের গ্যাসের শূন্য ডিগ্রি সেলসিয়াসে যে আয়তন, তার ১/২৭৩ বংশ বৃদ্ধি বা হ্রাস হ্রাস পায়।
চার্লসের সূত্রের গাণিতিক রূপ :
নিচের লিংকে ক্লিক করো।
চালর্স ও বয়েলের সূত্রের সমন্বয় সূত্রটি লেখাে।
Ans: PV = KT [P = চাপ, V = আয়তন, T = পরম স্কেলে উষ্ণতা এবং K = ধ্রুবক]
বয়েলের সূত্রে ধ্রুবক কী কী?
Ans: গ্যাসের চাপ ও ভর।
চার্লসের সূত্রে ধ্রুবক কী কী?
Ans: গ্যাসের উষ্ণতা ও ভর।
বয়েল ও চার্লসের সূত্রে ধ্রুবক কি ?
গ্যাসের ভর।
পরম শূন্য উষ্ণতা :
চার্লসের সূত্রের গাণিতিক প্রয়োগ অনুযায়ী - 273 ডিগ্রি সেলসিয়াস উষ্ণতায় সকল গ্যাসের আয়তন শূন্য হয়ে যায়। এই উষ্ণতা কে পরমশূন্য উষ্ণতা বলে।
0° C এবং 0 k-এর মধ্যে কোন উষ্মতাটি অধিক?
Ans : 0° C = (0 + 273) K = 273K
অর্থাৎ, 0° C উষ্ণতা টি অধিক।
0°C এবং 0°F-এর মধ্যে কোনটি বেশি ?
Ans: 0°C
27°C উষ্ণতার মান পরম স্কেলে কত?
Ans: 273+27 =310 K
সেলসিয়াস স্কেলে দু’টি বস্তুর তাপমাত্রার পার্থক্য 10° হলে কেলভিন স্কেলে এই তাপমাত্রার পার্থক্য কত হবে?
Ans: 10° সেলসিয়াস হবে।
কোনাে একদিনের তাপমাত্রা সেলসিয়াস স্কেলে 37°C হলে কেলভিন স্কেলে তাপমাত্রার মান কত?
Ans: 273+37=310 K
বিভিন্ন স্কেলে পরমশূন্য উষ্ণতার মান:
- 273 ডিগ্রি সেলসিয়াস
- 459.67 ডিগ্রী ফারেনহাইট
0 কেলভিন।
উষ্ণতার পরম স্কেলে অর্থাৎ কেলভিন স্কেলে ঋণাত্মক তাপমাত্রা থাকে না কেন?
কেলভিন স্কেলের সর্বনিম্ন তাপমাত্রা 0 কেলভিন। এই উচ্চতার কম উষ্ণতায় অর্থাৎ ঋণাত্মক কেলভিন তাপমাত্রায় ওই গ্যাসের আয়তন অথবা চাপ ঋণাত্মক হয়ে পড়ে। কিন্তু এরূপ ঋণাত্মক আয়তন বা চাপ অর্থহীন। সেই জন্য পরমশূন্য অপেক্ষা নিম্ন তাপমাত্রা সম্ভব নয়।
পরম শূন্য তাপমাত্রার মান সেলসিয়াস স্কেলে কত?
Ans: -273°C
কেলভিন স্কেলে প্রমাণ তাপমাত্রার মান কত?
Ans: 273k
t°C উষ্মতাকে কেলভিন স্কেলে প্রকাশ করাে।
Ans: t°C = (t+ 273) k
তাপমাত্রার সেলসিয়াস ও পরম স্কেলের মধ্যে সম্পর্কটি লেখাে।
Ans: T = 273 + t
উষ্ণতার পরম স্কেলে জলের স্ফুটনাঙ্ক কত?
Ans; 273+100=373k
পরম উষ্ণতায় বিশুদ্ধ জলের হিমাঙ্ক কত?
Ans: 273k
30°C এবং 300k-এর মধ্যে কোন উষ্মতাটি অধিক?
Ans: 30°C
স্থির চাপে পরম উষ্ণতা ও আয়তনের (V-T) লেখচিত্র কেমন হবে?
স্থির আয়তনে গ্যাসের চাপ ও পরম উষ্ণতার (P-T) লেখচিত্র কেমন হবে?
বয়েল ও চার্লসের সূত্রের সমন্বয় সমীকরণটি লেখ ।
অথবা, পরিবর্তনশীল চাপ ও পরিবর্তনশীল উষ্ণতার ক্ষেত্রে গ্যাস সমীকরণ লেখ।
PV = KT {K হল ধ্রুবক । }
1 গ্রাম অনু গ্যাসের ক্ষেত্রে ক এর মান কত ?
1 গ্রাম অনু গ্যাসের ক্ষেত্রে K এর মান R ।
‘R’ অক্ষর দ্বারা কোন ভৌত রাশিকে বােঝানাে হয়?
Ans: সর্বজনীন গ্যাস ধ্রুবক।
আদর্শ গ্যাস সমীকরণটি লেখাে।
Ans: PV = nRT [R = সর্বজনীন গ্যাস ধ্রুবক, n = মােল সংখ্যা]।
STP-তে এক মােল যে কোনাে গ্যাসের আয়তন কত?
Ans: 22.4 লিটার।
R এর মান কত ?
সিজিএস পদ্ধতিতে: 8.314×10^7 আর্গ.মােল -¹.k -¹
এস আই পদ্ধতিতে : 8.314 জুল.মােল -¹.k -¹
গ্যাসের গতিতত্ত্বের স্বীকার্য:
1. গ্যাস অসংখ্য ক্ষুদ্র কণা দিয়ে গঠিত।
2. গ্যাসের অনুগুলির গোলাকার এবং কঠিন। অনুগুলির মধ্যে আন্তঃআণবিক ব্যবধান বেশি বলে কোনো আকর্ষণ বিকর্ষণ থাকেনা।
3. অনু গুলিকে বিন্দু ঘর হিসেবে ধরা যায়।
4. গ্যাসের অনুগুলির সম্ভাব্য সব দিকে দ্রুত গতিতে সরলরেখায় বিচরণ করে।
5. গ্যাস আধারের গোত্রের সঙ্গে গ্যাসীয় অনুগুলির সংঘর্ষেই গ্যাসের চাপের সৃষ্টি হয়।
6. গ্যাসের অনুগুলির সম্পূর্ণরূপে স্থিতিস্থাপক।
7. পরস্পরের সঙ্গে ধাক্কা খেলেও স্থিতাবস্থায় একক আয়তনে অনুর সংখ্যা অপরিবর্তিত থাকে।
বিভিন্ন সময়ে বিভিন্ন গ্যাসের অণুর বেগ বিভিন্ন হয় বলে তাদের গতিশক্তি ও বিভিন্ন হয়।
ফারেনহাইট স্কেলে চরম শূন্যের মান কত?
Ans: – 459.4°F
কোন ধর্মের জন্য ধূপের গন্ধ চারিদিকে ছড়িয়ে পড়ে?
Ans: গ্যাসের ব্যাপন ধর্ম।
প্রমাণ বায়ুমণ্ডলীয় চাপের মান কত?
Ans: 76 সেমি পারদস্তম্ভের চাপ।।
গ্যাসের আয়তন এর উপর চাপের প্রভাব:
স্থির উষ্ণতায় কোন নির্দিষ্ট ভরের গ্যাসের উপরে চাপ যত বৃদ্ধি করা হবে আয়তন ততই হ্রাস পাবে।
গ্যাসের অনুগুলির বেগের উপর উষ্ণতার প্রভাব
উষ্ণতা বৃদ্ধি করলে গ্যাসের অনুগুলির বেগ বৃদ্ধি পায়। তাই গতিশক্তি ও বৃদ্ধি পায়।
কখন বাস্তব গ্যাস গুলি আদর্শ গ্যাসের মত আচরণ করবে?
খুব উঁচু উচ্চতা বা খুব নিম্নচাপে বাস্তব গ্যাস আদর্শ গ্যাসের ন্যায় আচরণ করবে।
কোন তাপমাত্রায় গ্যাসের অণুগুলির বেগ শূন্য হয় ?
Ans: –273°C উষ্ণতায়।
কোন উয়তায় গ্যাসের আয়তন শূন্য হয়ে যায় ?
Ans: প্রমাণ উষ্ণতায় বা –273°C উষ্ণতায়।
পদার্থ মাত্রই অণু দিয়ে গঠিত। তাপ শক্তির একটি রূপ এবং তা পদার্থের অণুগুলোর গতির সাথে সম্পর্কিত। পদার্থের অণুগুলো সব সময়ই গতিশীল। বায়বীয় পদার্থের অণুগুলো মোটামুটি স্বাধীনভাবে কোনো বদ্ধ স্থানের মধ্যে নড়াচড়া করতে পারে। বায়বীয় পদার্থের আচরণের নিয়মগুলো পেতে যে তত্ত্ব সৃষ্টি হয়েছে সেই তত্ত্বই গ্যাসের গতিতত্ত্ব নামে পরিচিত। গ্যাসের অণুগুলোর গড় গতিশক্তি গ্যাসের পরম তাপমাত্রার সমানুপাতিক। যে গ্যাসের অণুগুলো যেকোনো তাপমাত্রা এবং চাপে গতিতত্ত্বের মৌলিক স্বীকার্যগুলো মেনে চলে এবং স্বীকার্য থেকে লব্ধ সূত্রানুযায়ী আচরণ করে সে গ্যাসকে আদর্শ গ্যাস বলে।
গ্যাসের অণুর মৌলিক স্বীকার্যসমূহ
১। সকল গ্যাস অণুর সমন্বয়ে গঠিত। একটি গ্যাসের সকল অণু সদৃশ এবং একটি গ্যাসের অণু অন্য গ্যাসের অণু থেকে ভিন্ন।
২। গ্যাসের অণুগুলোর আকার অণুগুলোর মধ্যবর্তী দূরত্বের তুলনায় নগণ্য।
৩। গ্যাসের অণুগুলো কঠিন স্থিতিস্থাপক সদৃশ গোলক বিশেষ এবং অণুগুলোর নিজেদের মধ্যে কোনো আকর্ষণ বা বিকর্ষণ বল নেই। এদের শক্তি সম্পূর্ণটাই গতিশক্তি।
৪। গ্যাসের অণুগুলো অক্রম বা এলোমেলো (random) গতিতে গতিশীল এবং এগুলো নিউটনের গতিসূত্রসমূহ মেনে চলে। অণুগুলো সকল দিকে গতিশীল এবং এদের বেগের মান বিভিন্ন।
৫। অণুগুলো নিরবচ্ছিন্নভাবে একে অপরের সাথে এবং আধারের দেয়ালের সাথে সংঘর্ষে লিপ্ত হচ্ছে। দুটি সংঘর্ষের মধ্যবর্তী সময়ে একটি অণু সরলরেখায় চলে। দুটি সংঘর্ষের মধ্যবর্তী সময়ে একটি অণু যে দূরত্ব অতিক্রম করে তাকে মুক্ত পথ বলে।
# বহুনির্বাচনী প্রশ্ন
যেকোন গ্যাসের নমুনায় অনেক অণু বিদ্যমান থাকে। অণুসমূহের মধ্যে অবিরাম সংঘর্ষের ফলে তাদের মোট গতি শক্তির কোন পরিবর্তন না হলেও বিভিন্ন অণুর গতিবেগের পরিবর্তন হয়। এ সব অণুর গতিবেগ কোন সময় সমান নয়, কোন মুহূর্তে একটি অণুর গতিবেগ প্রায় শূন্য হতে পারে, সে সময় আরেকটি অণুর গতিবেগ তা অপেক্ষা কয়েকশ গুণ বেশি হতে পারে। পর মুহূর্তে প্রায় নিশ্চল অণুটি খুব দ্রুতগতি সম্পন্ন হতে পারে। দ্রুততর অণুটি একসময় শ্লথ হয়ে যেতে পারে, অথবা আরো দ্রুততরও হতে পারে। এ অবস্থায় কোন অণুর গতিবেগ নির্দিষ্ট করে বলা সম্ভব নয়। তবে তাদের গড় গতিবেগ হিসাব করা যায়। অপরদিকে বিভিন্ন ধরনের গড় হিসাব করা যায়।
গড় গতিবেগ (Mean Velocity)
কোন গ্যাসের অণুসমূহের বিভিন্ন গতিবেগের পাটীগণিতীয় গড়কে সে গ্যাসের অণুসমূহের গড় গতিবেগ বলা হয়। মনে করি, একটি গ্যাসাধারে গ্যাসের N সংখ্যক অণু আছে, তাদের গতিবেগ যথাক্রমে 1, 2, 3, 4....CN, সেক্ষেত্রে গড় গতিবেগ
C = (c1 + c2 + c3 + .......+ CN) / N
গড় বেগ (C) কে নিম্ন সমীকরণ দ্বারাও প্রকাশ করা হয়-
C = √ (8RT / TIM)
বর্গমূল-গড়-বর্গবেগ বা RMS বেগ
কোন গ্যাসের অণুসমূহের গতিবেগের বর্গের গড় মানের বর্গমূলকে গ্যাসটির অণুসমূহের বর্গমূল-গড়-বর্গবেগ বা RMS বেগ (root mean square velocity) বলা
হয়। মনে করি, একটি গ্যাসাধারে N সংখ্যক অণু আছে, তাদের গতিবেগ যথাক্রমে C1, 2, 3, C4.....CN । তখন বর্গমূল-গড়-বর্গবেগকে c দ্বারা চিহ্নিত করলে,
c = √ (c12 + c22 + c32 + c42 + + c2) / N
RMS বেগ (c)-কে পরম তাপমাত্রা ও মোলার ভরের সাথে সম্পর্ক স্থাপন করে নিম্ন সমীকরণ দ্বারাও প্রকাশ করা হয়-
C = √ (3RT / M)
মনে রাখতে হবে, গ্যাসের অণুসমূহের মোট গতিশক্তি নির্ণয়ের জন্য RMS বেগ জানা প্রয়োজন।
বর্গমূল-গড়-বৰ্গ গতিবেগ প্রয়োজনীয় কেন?
বর্গমূল-গড়-বর্গ গতিবেগ (c) হচ্ছে এমন একটি বেগ, যা প্রতিটি অণুর সাধারণ গতিবেগ ধরে অণুসমূহের গতিশক্তি হিসাব করলে তাদের প্রকৃত মোট গতিশক্তি পাওয়া যায়। গড় গতিবেগ (c) বা সবচেয়ে সম্ভাব্য গতিবেগ হতে সরাসরি গতিশক্তি পাওয়া যায় না। মনে করি একটি গ্যাসের নমুনায় N সংখ্যক অণু আছে, এদের গতিবেগ যথাক্রমে c1 c2 c3......CN এবং প্রতিটি অণুর ভর m.
অণুসমূহের মোট গতিশক্তি
= 1/2 mc12 + 1/2 mc2 2 + 1 / 2m 3 2 + ....... + 1/2 mc 2
= 1/2 m (c12 + c22 + c3 2 +......+ CN). --(1)
আবার প্রতিটি অণুর সাধারণ গতিবেগ c ধরা হলে প্রতিটি অণুর গতিশক্তি = (1/2)mc2। সুতরাং N টি অণুর সর্বমোট গতিশক্তি C
= (1/2) mNc2
= (1/2) mN [√(Cl2 + c2 2 + c3 2 +......... ... + c2) / N] - -(2)
= (1/2) mN [(c12 + c2 2 + c3 2 + + Cr) / N]
= (1/2)m (c12 + c2 2 + c3 2 +......... ...+CN²)
সমীকরণ (1) ও (2) তুলনা করলে দেখা যায় যে, বর্গমূল-গড়-বর্গ গতিবেগকে প্রতিটি অণুর সাধারণ গতিবেগ ধরে অণুসমূহের মোট গতিশক্তি হিসাব করা হলে তা প্রকৃত গতিশক্তির সমান হয়।
# বহুনির্বাচনী প্রশ্ন
# বহুনির্বাচনী প্রশ্ন
আদর্শ গ্যাস কাকে বলে?
যেসব গ্যাস সকল চাপ এবং তাপমাত্রায় বয়েল এবং চার্লসের সূত্র অর্থাৎ আদর্শ গ্যাস সমীকরণ PV=nRT মেনে চলে তাদের আদর্শ গ্যাস বলে।
বাস্তব গ্যাস কাকে বলে?
যে সমস্ত গ্যাস যে কোনো চাপ এবং তাপমাত্রায় আদর্শ গ্যাস সমীকরণ PV=nRT -কে সঠিকভাবে মেনে চলে না তাদের বাস্তব গ্যাস বলে।
আদর্শ গ্যাস ও বাস্তব গ্যাসের পার্থক্য
১) আদর্শ গ্যাস : আদর্শ গ্যাস সকল উষ্ণতা ও চাপে PV=nRT সমীকরণ মেনে চলে।
বাস্তব গ্যাস : বাস্তব গ্যাস PV=nRT সমীকরণ মেনে চলে না।
২) আদর্শ গ্যাস : প্রকৃতিতে কোন গ্যাস আদর্শ গ্যাস নয়।
বাস্তব গ্যাস : প্রকৃতিতে সব গ্যাসীয় পদার্থ বাস্তব গ্যাস।
৩) আদর্শ গ্যাস : আদর্শ গ্যাসের ক্ষেত্রে অনুগুলির মধ্যে পারস্পরিক আকর্ষণ ক্রিয়া করে না। বাস্তব গ্যাস : বাস্তব গ্যাসের ক্ষেত্রে অনুগুলির মধ্যে পারস্পরিক আকর্ষণ ক্রিয়া করে।
৪) আদর্শ গ্যাস : আদর্শ গ্যাসের ক্ষেত্রে অনুগুলির আয়তন পাত্রের তুলনায় নগণ্য হয়। বাস্তব গ্যাস : বাস্তব গ্যাসের ক্ষেত্রে অনুগুলির আয়তন পাত্রের তুলনায় নগণ্য হয় না।
রেখাগুলোকে দুভাগে ভাগ করা যায়।
- ১ম ধরণের রেখা সাধারণ তাপমাত্রায় H2, He প্রতি হালকা গ্যাসের ক্ষেত্রে পাওয়া যায়। এসব গ্যাসের ক্ষেত্রে চাপ বৃদ্ধি করলে PVএর পরিমাণ ক্রমাগত বৃদ্ধি পায়।
- O2,N2,CO2 প্রতি ভারী গ্যাসের ক্ষেত্রে ২য় ধরনের রেখা পাওয়া যায়। এসব ক্ষেত্রে চাপ বৃদ্ধির সাথে সাথে PV এর মান আদর্শ গ্যাস হতে হ্রাস পায় এবং তা একটি নূন্যতম মানে পৌছে । চাপ বৃদ্ধির সাথে সাথে তা আবার বৃদ্ধি পেতে থাকে।
তাপমাত্রার প্রভাব : H2, He প্রভৃতির ক্ষেত্রে তাপমাত্রা কমতে থাকলে এদের লেখচিত্র দ্বিতীয় ধরনের চিত্রের মত হয়। আবার যথেষ্ট উচ্চ তাপমাত্রায় দ্বিতীয় ধরনের লেখচিত্র ১ম ধরণের অনুরূপ হয়। এ থেকে সিদ্ধান্ত হলো,
- আদর্শ গ্যাসের ক্ষেত্রে PV বেখাটি p অক্ষের সমান্তরাল হয় যা ডট লাইন দ্বারা দেখানো হয়েছে।
- আদর্শ আচরণ হতে বিচ্যুতির ধরন শুধুমাত্র গ্যাসের প্রকৃতির উপর নয় বরং তাপমাত্রার উপর নির্ভরশীল।
- তাপমাত্রা যতই ক্রান্তি বা সন্ধি তাপমাত্রার নিকটে হয় এবং গ্যাসের উপর প্রযুক্ত চাপ যত বেশি হয় আর বিচ্যুতি আদর্শ আচরণ হতে তত বেশী হয়।
প্রশ্ন : অ্যামাগার লেখচিত্রে (Amaga chart) বাস্তব গ্যাসের রেখাগুলো ভিন্ন হবার কারণ ব্যাখ্যা কর।
উত্তর : বাস্তব গ্যাসের ক্ষেত্রে 1 mol পরিমাণ গ্যাসের জন্য Van der Waal’s সমীকরণকে নিম্নরূপে লেখা যায়,
(P+v2a)(v−b)=RT………………(i)
H2,He প্রভৃতির ক্ষেত্র :
এ ধরনের গ্যাসের অণুগুলোর ভর কম। ফলে সাধারণ তাপমাত্রা এবং নিম্নচাপে এদের মধ্যে আন্তঃআণবিক আকর্ষণ বলের মান খুবই কম পরিমাণে থাকে। এতে অন্তঃআণবিক আকর্ষণজনিত ধ্রুবক এর মান ক্ষুদ্র এবং v এর বড় মানের জন্য v2a এর মান অত্যন্ত কম হয়। এ অবস্থায় এদের মধ্যে আকর্ষণজনিত সংশোধনী পদ v2a কে উপেক্ষা করা যায়।
∴ (i) নং সমীকরণকে নিম্নরূপে লেখা যায়,
P(v-b)= RT
বা, PV=RT+Pb
বা, RTPV=1+Pb
বা, Z = 1+Pb
উপরোক্ত সম্পর্ক হতে দেখা যায়, PV এর মান RT অপেক্ষা বেশি হওয়ায় রেখাটি উর্ধ্বগামী হয়। আবার, চাপ বৃদ্ধির সাথে সাথে Pb এর মান ক্রমাগত বৃদ্ধি পেতে থাকে বলে PV এর মান ও বাড়ে এবং রেখার উর্ধ্বগামীতা বজায় থাকে। তাছাড়া সব অবস্থায় Z > 1 হওয়ায় রেখাটি আদর্শ রেখার উপরে থাকে।
O2, N2,CO2 প্রভৃতি জারী গ্যাসের ক্ষেত্রে :
নিম্নচাপে : এ অবস্থায় গ্যাসের আয়তন অর্থাৎ V এর মান অনেক বেশি হয়। ফলে V এর তুলনায় গ্যাস অণুসমূহের কার্যকর নিজস্বআয়তন b খুবই কম হয় বলে একে উপেক্ষা করা যায়। ফলে, (i) সমীকরণকে নিম্নরূপে লেখা যায়,
(P+v2a)V=RT
বা, PV+va=R
বা, PV=RT−va
বা, RTPV=1−VRTa
বা, Z=1−VRTa
অর্থাৎ, নিম্নচাপে PV এর মান RT অপেক্ষা কম হয় বলে রেখাটি নিম্নগামী হয়। অর্থাৎ Z<1 হওয়ায় রেখাটি আদর্শ গ্যাসের রেখার নীচে থাকে। আবার চাপ বৃদ্ধি পেলে আয়তন হ্রাস পায়। তাই চাপের মান বাড়াতে থাকলে va এর মান বাড়ে ফলে PV এর মান আরও কমতে থাকে অর্থাৎ রেখা আরও নিম্নগামী হয়।
উচ্চচাপে : উচ্চচাপে গ্যাসের আয়তন খুব কম হয় এবং এ অবস্থায় গ্যাস অণুর নিজস্ব আয়তন ‘b’ এর মানকে V এর সাপেক্ষে উপেক্ষা করা যায় না। উচ্চ চাপে অণুগুলো পরস্পর এত নিকটবর্তী হয় যে, এদের মধ্যে বিকর্ষণ বল ক্রিয়াশীল হয়। তাই এই v2a এর মান P এর তুলনায় কম হয়। v2a কে p এর সাপেক্ষে উপেক্ষা করা যায়।
এমতাবস্থায় (ii) ন সমীকরণকে নিম্নরূপে লেখা যায়,
P(V-b)=RT
বা, PV=RT+Pb
বা, RTPV=1+RTPb
বা, Z=1+RTPb
অর্থাৎ উচ্চ চাপে PV এর মান RT অপেক্ষা বৃদ্ধি পাওয়ায় রেখাটি পুনরায় উর্ধ্বগামী হয়। কারণ এক্ষেত্রে Z > 1 তাই O2, N2,CO2 প্রভৃতি গ্যাসের ক্ষেত্রে অ্যামাগা রেখা (Amaga Line) একটি সর্বনিম্ন বিন্দুতে পৌঁছানোর পর আবার ক্রমাগত বাড়ে।
প্রশ্ন : পেষণ গুণাঙ্কের মাধ্যমে কীরূপে বাস্তব গ্যাসের আচরণ সম্পর্কে ধারণা পাওয়া যায়।
উত্তর : আদর্শ গ্যাসসমূহ PV=nRT সমীকরণ মেনে চলে। কিন্তু বাস্তব গ্যাস সমূহের ক্ষেত্রে,
PV≠nRT
PV=ZnRT
Z=nRTPV Z=nRTPV
এখানে Z হচ্ছে পেষণ গুনাঙ্ক বা সংকোচনশীল গুণাংক (Corpressibility factor) যা P এবং T এর উপর নির্ভরশীল, 1mol আদর্শ গ্যাসের ক্ষেত্রে Z = 1
একই অপমাত্রা ও চাপে আদর্শ গাস ও বাস্তব গ্যাস তুলনা করে পাই,
nRTPV0=1 (আদর্শ গ্যাসের ক্ষেত্রে)
nRTPV=Z (বাস্তব গ্যাসের ক্ষেত্রে)
∴Z=V0V =একই তাপমাত্রা এ চাপে n মোল আদর্শ গ্যাসের আয়তননির্দিষ্ট তাপমাত্রা ও চাপে n মোল বাস্তব গ্যাসের আয়তন
অর্থাৎ পেষন গুণাংক প্রকৃতপক্ষে বাস্তব গ্যাসের মোলার আয়তন এবং আদর্শ গ্যাসের মোলার আয়তনের অনুপাত নির্দেশ করে। Z এর মান 1 অপেক্ষা কম বা বেশি হলে তা আদর্শ আচরণ হাতে বিচ্যুতি দেখায়। যেমন :
i. যখন V=Vo তখন Z = 1 অর্থাৎ বাস্তব গ্যাসটি আদর্শ গ্যাসের মত আচরণ করে।
ii. যখন V>Vo তখন Z > 1 হয়, অর্থাৎ একই তাপমাত্রা ও চাপে বাস্তব গ্যাসটি আদর্শ গ্যাস অপেক্ষা বেশি আয়তন দখল করে।অর্থাৎ বাস্তব গ্যাসটি কম পেষণ যোগ্য বা সংকোনশীল হয় এক বিচ্যুতি বেশি হয়। একে ধনাত্বক বিচ্যুতি বলে। হালকা গ্যাসেরক্ষেত্রে এ বিচ্যুতি দেখা যায়। এ ধরনের অণুগুলোর ভর কম হওয়ায় আন্তঃআণবিক আকর্ষণ বলের মান খুবই কম। তাই এ সমস্ত গ্যাসগুলোকে সহজে তরলে পরিণত করা যায় না। তাছাড়া এদের পানিতে দ্রব্যতা কম যেমন: H2,He ইত্যাদি।
iii. যখন V

বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক (Compressibility Factor)
সংকোচনশীলতা গুণাঙ্কের ধারণা
বাস্তব গ্যাসের আচরণকে আদর্শ গ্যাস থেকে পৃথক করতে সংকোচনশীলতা গুণাঙ্ক Z ব্যবহার করা হয়। এটি গ্যাসের প্রকৃত চাপ-আয়তন-তাপমাত্রার সম্পর্কের মাপকাঠি।
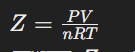
যেখানে, Z = 1 হলে গ্যাসটি আদর্শ গ্যাসের মতো আচরণ করে।
বাস্তব গ্যাসে Z -এর গুরুত্ব
- Z > 1 : গ্যাসের অণুগুলোতে বিকর্ষণ বল বেশি কার্যকর।
- Z < 1 : গ্যাসের অণুগুলোতে আকর্ষণ বল বেশি কার্যকর।
বাস্তব গ্যাসে সংকোচনশীলতা গুণাঙ্ক গ্যাসের পৃষ্ঠের অবস্থা এবং চাপ-তাপমাত্রার ওপর নির্ভর করে।
পেষণ গুণাঙ্ক (Compressibility)
পেষণ গুণাঙ্কের সংজ্ঞা
পেষণ গুণাঙ্ক গ্যাসের সংকোচন ক্ষমতার পরিমাপ। এটি নির্ণয় করা হয় নিচের সমীকরণে:
এটি গ্যাসের আকার সংকোচনের হার নির্দেশ করে।
পেষণ গুণাঙ্ক ও বাস্তব গ্যাস
উচ্চ চাপ এবং নিম্ন তাপমাত্রায় বাস্তব গ্যাসের পেষণ গুণাঙ্ক উল্লেখযোগ্যভাবে পরিবর্তিত হয়। এটি আদর্শ গ্যাসের গুণাঙ্কের তুলনায় অনেক কম বা বেশি হতে পারে।
আদর্শ গ্যাস
আদর্শ গ্যাসের বৈশিষ্ট্য
আদর্শ গ্যাস এমন একটি কাল্পনিক গ্যাস, যার অণুগুলো
- পরস্পরের ওপর কোনো আকর্ষণ বা বিকর্ষণ বল প্রয়োগ করে না।
- নিজস্ব আকার বা আয়তন নেই।
- গ্যাসের আচরণ বোইলস এবং চার্লসের নিয়ম মেনে চলে।
আদর্শ গ্যাস সমীকরণ
আদর্শ গ্যাস সমীকরণ হলো:
PV = nRT
যেখানে,
P : চাপ, V : আয়তন, T : তাপমাত্রা, n : মোল সংখ্যা, R : গ্যাস ধ্রুবক।
বাস্তব ও আদর্শ গ্যাসের পার্থক্য
- বাস্তব গ্যাসে অণুর মধ্যে আকর্ষণ ও বিকর্ষণ বল থাকে, যা আদর্শ গ্যাসে অনুপস্থিত।
- বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক Z আদর্শ গ্যাসের ক্ষেত্রে ১ হয়, কিন্তু বাস্তব গ্যাসে তা ১-এর সমান নয়।
সারাংশ
বাস্তব গ্যাসের সংকোচনশীলতা গুণাঙ্ক ও পেষণ গুণাঙ্কের মাধ্যমে তাদের আচরণ ব্যাখ্যা করা হয়, যা আদর্শ গ্যাসের তুলনায় ভিন্ন। বাস্তব গ্যাসের গুণাবলী চাপ ও তাপমাত্রার উপর নির্ভর করে পরিবর্তিত হয়।
সাধারণত উচ্চ তাপমাত্রা ও নিম্ন চাপে অধিকাংশ বাস্তব গ্যাস মোটামুটিভাবে আদর্শ গ্যাস সূত্র মেনে চলে। যদিও অনেক বাস্তব গ্যাস আদর্শ আচরণ থেকে সামান্য বিচ্যুতি দেখায়। যে গ্যাসের ঘনীভবন তাপমাত্রা বা আদর্শ তরলের স্ফুটনাংক যতই STP থেকে দূরে থাকে এর বিচ্যুতির মাত্রা ততই বেশি।
বাস্তব গ্যাসসূমহের আদর্শ আচরণ হতে বিচ্যুতির অর্থাৎ PV = nRT পুরোপুরি না মানা, -এর দুটি কারণ আছে। এ কারণগুলো হলো-
১। আদর্শ গ্যাসের আণবিক গতিতত্ত্ব মতে, গ্যাসের অনুগুলোর মোট আয়তন গ্যাসপাত্রের মোট আয়তনের তুলনায় নগণ্য। হিসাব করে জানা গেছে, STP তে ১ মোল গ্যাসের অণুগুলোর মোট আয়তন গ্যাস পাত্রের মোট আয়তনের 0.05% হয়; যা মোটামুটিভাবে গতিতত্ত্বের স্বীকার্য মতে নগণ্য ধরা যায়। কিন্তু 500atm ও 0°C তাপমাত্রায় ঐ গ্যাসের অণুগুলোর আয়তন হয় মোট আয়তনের 20% যা কখনো নগণ্য নয়। এ কারণে উচ্চচাপে বাস্তব গ্যাসের আয়তন আদর্শ গ্যাস সূত্রের গণনা থেকে বেশি হয়।
২। আদর্শ গ্যাসের গতিতত্ত্বের অণুগুলোর মধ্যে কোনো আকর্ষণ বল নেই -এই স্বীকার্যটিও নিম্নচাপের ক্ষেত্রে বাস্তব গ্যাসের জন্য মোটামুটি প্রযোজ্য। কারণ তখন অণুগুলোর আকর্ষণ বল বেশী কার্যকরী থাকেনা। কিন্তু চাপ বাড়লে অণুগুলো খুব কাছে আসে; তখন আকর্ষণ বল অধিক কার্যকর হয়। সাধারণত আণবিক ব্যাসের দশগুণ দূরত্ব থেকে আন্তঃআণবিক আকর্ষণ বল কার্যকর হয় এবং দূরত্ব কমার সাথে এ বল বাড়ে। ফলে প্রদত্ত চাপে অণুগুলো কাছে আসতে আয়তন কমে যায়।
সুতরাং গ্যাসের আণবিক আয়তন গণ্য করলে মোট আয়তন V বেড়ে যায়। অপরদিকে আন্তঃআণবিক আকর্ষণ করলে মোট আয়তন V কমে যায় (অথবা প্রদত্ত V আয়তনে চাপ কমে যায়)। চাপমাত্রা মাঝামাঝি হলে এ দুই বিপরীত ফ্যাক্টর পরস্পরকে সাম্যাবস্থায় রাখে। কিন্তু তাপমাত্রা যেমন 350 atm এর উর্ধে আণবিক আয়তন এর প্রভাব প্রাধান্য পায়। তবে 10 atm থেকে কোনো কোনো গ্যাসে এর সুস্পষ্ট প্রভাব প্রাধান্য পায়।
# বহুনির্বাচনী প্রশ্ন
ওলন্দাজ বিজ্ঞানী ভ্যানডার ওয়ালস্ (Van der Waals) সর্বপ্রথম বলেন যে, গ্যাসের গতিতত্ত্বে যে সকল স্বীকার্যের উপর ভিত্তি করে আদর্শ গ্যাস সমীকরণ PV = nRT বের করা হয়েছে, তাতে দুটি ভুল আছে। যে কারণে বাস্তব গ্যাস আদর্শ গ্যাসের সমীকরণ মেনে চলে না, অর্থাৎ আদর্শ আচরণ করে না। তাই বিজ্ঞানী ড্যানভার ওয়ালস্ বাস্তব গ্যাসের জন্য আদর্শ গ্যাসের স্বীকার্য সংশোধন করেন। তার দুটো সংশোধন হচ্ছে-
গ্যাসের আয়তন সংশোধন : গ্যাসের গতিতত্ত্বে একটি স্বীকার্য হচ্ছে, গ্যাসের অণুসমূহের নিজস্ব আয়তন গ্যাস পাত্রের আয়তনের তুলনায় অনেক কম। কিন্তু বাস্তব ক্ষেত্রে তা পুরোপুরি সঠিক নয়। যেকোন গ্যাসকে খুব কম তাপমাত্রা ও খুব বেশি চাপে তরল এবং কঠিন পদার্থে পরিণত করা যায়। তরল এবং কঠিন উভয় অবস্থায় অণুসমূহ পরস্পরের খুব কাছাকাছি থাকে, তার সত্ত্বেও তরল ও কঠিন বস্তুর একটি আয়তন আছে, যা একেবারে কম নয়। তরল ও কঠিন পদার্থকে যথেষ্ট চাপ দিয়ে আর বেশি সংকোচন করা যায় না। এসব থেকে বোঝা যায় যে, গ্যাসের অণুসমূহের একটি আয়তন আছে, যা একেবারে কম না।
আদর্শ গ্যাস সমীকরণে গ্যাস অণুসমূহের মুক্ত চলাচলের জন্য আয়তন v ধরা হয়েছে। বাস্তবিকপক্ষে তা সঠিক নয়৷ এক মোল বাস্তব গ্যাসের অণুসমূহের কার্যকর নিজস্ব আয়তন b হলে n মোল গ্যাসের জন্য V থেকে nb বাদ দিতে হবে। অর্থাৎ গ্যাস অণুসমূহের জন্য মুক্ত স্থান = (V - nb) হবে।
গ্যাসের চাপ সংশোধন : গ্যাসের গতিতত্ত্বের আরেকটি স্বীকার্য হচ্ছে, অণুসমূহের মধ্যে কোন আকর্ষণ বা বিকর্ষণ নেই। এ ধারণাও সঠিক নয়। গ্যাসের অণুসমূহের মধ্যে কোন আকর্ষণ না থাকলে গ্যাসকে তরল বা কঠিন পদার্থে পরিণত করা যেত না এবং কঠিন ও তরল কোন পদার্থের অস্তিত্ব থাকত না। এছাড়া জুল-থমসনের পরীক্ষা থেকে অণুসমূহের আন্তঃআণবিক আকর্ষণের অস্তিত্বের সরাসরি প্রমাণ পাওয়া যায়। এ আকর্ষণ না থাকলে আদর্শ অবস্থায় গ্যাসের অণুসমূহ পাত্রের গায়ে যে পরিমাণ চাপ প্রয়োগ করতো, বাস্তব গ্যাসের ক্ষেত্রে এ আন্তঃআণবিক আকর্ষণের কারণে তা অপেক্ষা কিছু কম পরিমাণ চাপ প্রয়োগ করে। অর্থাৎ বাস্তব গ্যাস যে চাপ প্রয়োগ করে, তা একই অবস্থায় গ্যাসটি আদর্শ হলে যে চাপ প্রয়োগ করতো, তার চেয়ে কম। তাই বাস্তব গ্যাসের বেলায় চাপ P এর পরিবর্তে P + আন্তঃআণবিক আকর্ষণ বল হবে। ভ্যানডার ওয়ালস দেখান যে, n মোল গ্যাসের জন্য আন্তঃআণবিক আকর্ষণ বলের মান n2a / V2 এর সমান, এখানে a একটি ধ্রুবক। সুতরাং বাস্তব গ্যাসের চাপ হবে = P + (n²a / V²)
বাস্তব গ্যাসের বেলায় গ্যাসের নিজস্ব আয়তন ও আন্তঃআণবিক আকর্ষণজনিত চাপ সম্পৰ্কীয় উভয় বিচ্যুতির হিসাব করে বিজ্ঞানী ভ্যানডার ওয়ালস PV = WRT সমীকরণে সংশোধন এনে যে সমীকরণ তৈরি করেন, তা ভ্যানডার ওয়ালস্ সমীকরণ নামে পরিচিত। সুতরাং বাস্তব গ্যাসের অবস্থার সমীকরণটি হবে এমন-
(P + n²a/V²) (V - nb) = nRT
1 mol গ্যাসের জন্য এ সমীকরণে n = 1 ধরলে ভ্যানডার ওয়ালস্ সমীকরণটি দেখতে এমন হবে-
(P + a/V2) (V – b) = RT
উদাহরণ- 32g অক্সিজেন গ্যাসের জন্য ভ্যানডার ওয়ালস সমীকরণটি লিখ।
সমাধান- অক্সিজেন গ্যাসের গ্রাম আণবিক ভর হল 32g। সুতরাং 32g অক্সিজেন = 1 mol অক্সিজেন। ভ্যানডার ওয়ালস্ সমীকরণ অনুসারে- (P + n2a/V2) (V – nb) = nRT, এখানে n = গ্যাসের মোল সংখ্যা।
1 mol অক্সিজেন গ্যাসের জন্য এ সমীকরণে n = 1 বসিয়ে পাই,
(P + a/V2) (V – b) = RT
এটিই 1 মোল অক্সিজেন বা 32g অক্সিজেনের জন্য ভ্যানডার ওয়ালস্ সমীকরণ।
বাস্তব গ্যাসসমূহের আদর্শ গ্যাসের মত আচরণের শর্ত
গ্যাসের তাপমাত্রা যত বেশি হয় এবং চাপ যত কম হয়, গ্যাসের আয়তন তত বেশি হয়। গ্যাসের আয়তন যত বেশি হয়, তার তুলনায় গ্যাস অণুসমূহের আয়তন তত কম হয়। সুতরাং গ্যাসের গতিতত্ত্বের প্রথম ভুল দূর হয়। আবার গ্যাসের আয়তন যত বেশি হয়, অণুসমূহের মধ্যকার গড় দূরত্ব তত বেশি হয়, ফলে তাদের মধ্যে গড় আকর্ষণ তত কম হয়। সুতরাং গ্যাসের গতিতত্ত্বের দ্বিতীয় ভুলও দূর হয়। এ কারণে যতই বেশি তাপমাত্রা এবং কম চাপ ব্যবহৃত হয়, ততই বাস্তব গ্যাসের আচরণ আদর্শ গ্যাসের মত হয়।
যে উচ্চ তাপমাত্রার কোন বাস্তব গ্যাস আদর্শ গ্যাসের মত আচরণ করে এবং গ্যাসসূত্র মেনে চলে, ঐ তাপমাত্রাকে 'বয়েলের তাপমাত্রা' বলা হয়।
# বহুনির্বাচনী প্রশ্ন
গ্যাস সিলিন্ডারজাতকরণে গ্যাস সূত্রের প্রয়োগ
গ্যাস সিলিন্ডারজাতকরণ একটি গুরুত্বপূর্ণ প্রক্রিয়া, যেখানে বিভিন্ন গ্যাসকে সিলিন্ডারে সংরক্ষণ করা হয়। এই প্রক্রিয়ায় গ্যাস সূত্র বা গ্যাস আইনগুলোর (Gas Laws) ব্যবহার অত্যন্ত গুরুত্বপূর্ণ। গ্যাসের চাপ, তাপমাত্রা এবং আয়তন সম্পর্কিত এই সূত্রগুলো সিলিন্ডারে গ্যাস সংরক্ষণের সময় সঠিক অবস্থান নির্ধারণে সহায়ক।
গ্যাস সূত্রের ভূমিকা
- বয়েলের সূত্র (Boyle's Law):
- গ্যাসের চাপ এবং আয়তনের মধ্যে একটি বিপরীত সম্পর্ক রয়েছে।
- নির্দিষ্ট তাপমাত্রায় সিলিন্ডারের আয়তন কমালে চাপ বাড়ে।
- গ্যাস সিলিন্ডারে গ্যাস সংকোচন (compression) করার সময় এই সূত্রটি প্রয়োগ করা হয়।
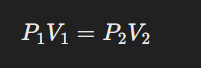
- চার্লসের সূত্র (Charles's Law):
- গ্যাসের আয়তন এবং তাপমাত্রার মধ্যে একটি সরাসরি সম্পর্ক রয়েছে।
- তাপমাত্রা বাড়লে গ্যাসের আয়তনও বাড়ে।
- সিলিন্ডারে তাপমাত্রা নিয়ন্ত্রণের মাধ্যমে গ্যাসের স্থায়িত্ব বজায় রাখা হয়।
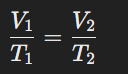
- গ্যাসের আদর্শ সূত্র (Ideal Gas Law):
- গ্যাসের চাপ, আয়তন, তাপমাত্রা এবং মোল সংখ্যা (n) এর সম্পর্ক নির্ধারণ করে।
- গ্যাস সিলিন্ডারে কতটুকু গ্যাস মজুত করা যাবে তা নির্ধারণে এই সূত্রটি ব্যবহার করা হয়।

সিলিন্ডারের নকশা ও গ্যাস সূত্রের প্রভাব
- চাপের সীমা নির্ধারণ: সিলিন্ডারের উপাদান এবং গ্যাসের চাপের উপর ভিত্তি করে এর সর্বোচ্চ ধারণক্ষমতা নির্ধারণ করা হয়।
- তাপমাত্রা প্রতিরোধ: গ্যাস সংকোচনের সময় তাপ উৎপন্ন হয়, যা চার্লসের সূত্র দ্বারা বিশ্লেষণ করা হয়।
- নিরাপত্তা ব্যবস্থা: অতিরিক্ত চাপ বা তাপমাত্রা বেড়ে গেলে সিলিন্ডার বিস্ফোরণ এড়ানোর জন্য সুরক্ষার ব্যবস্থা রাখা হয়।
গ্যাস সিলিন্ডারজাতকরণের কার্যকারিতা
- বিপণনে সহজতা: সংকুচিত গ্যাস পরিবহন সহজ হয়।
- দীর্ঘস্থায়ী সংরক্ষণ: সঠিক তাপমাত্রা ও চাপ বজায় রেখে দীর্ঘ সময় গ্যাস সংরক্ষণ করা সম্ভব।
- ব্যবহারের নির্ভুলতা: সিলিন্ডার থেকে নির্ধারিত পরিমাণ গ্যাস ব্যবহারের জন্য চাপ নিয়ন্ত্রণ করা যায়।
# বহুনির্বাচনী প্রশ্ন
বজ্রপাতের সময় বায়ুমণ্ডলে রাসায়নিক বিক্রিয়া
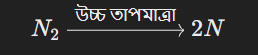
বজ্রপাতের সময় প্রচণ্ড তাপমাত্রা এবং চাপ সৃষ্টি হয়, যা নাইট্রোজেন এবং অক্সিজেনের অণুগুলোর মধ্যে রাসায়নিক বিক্রিয়া ঘটায়। এই প্রক্রিয়ার মাধ্যমে নাইট্রোজেন গ্যাস (N₂) ভেঙে যায় এবং তা অক্সিজেনের সঙ্গে যুক্ত হয়ে নাইট্রোজেন অক্সাইড (NO এবং NO₂) তৈরি করে।
বিক্রিয়ার ধাপ:
নাইট্রোজেনের ভাঙন:
উচ্চ তাপমাত্রায় (প্রায় ৩০,০০০ ডিগ্রি সেলসিয়াস) বাতাসে বিদ্যমান নাইট্রোজেন গ্যাস (N₂) পৃথক হয়ে যায়।
অক্সিজেনের সঙ্গে বিক্রিয়া:
ভাঙা নাইট্রোজেন অণু অক্সিজেনের সঙ্গে বিক্রিয়া করে নাইট্রিক অক্সাইড (NO) তৈরি করে।
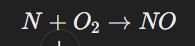
নাইট্রিক অক্সাইড থেকে নাইট্রোজেন ডাই অক্সাইড:
নাইট্রিক অক্সাইড বাতাসে আরও অক্সিজেনের সঙ্গে বিক্রিয়া করে নাইট্রোজেন ডাই অক্সাইড (NO₂) তৈরি করে।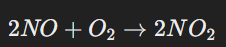
নাইট্রিক অ্যাসিড গঠন:
NO₂ জলীয় বাষ্পের সঙ্গে বিক্রিয়া করে নাইট্রিক অ্যাসিড (HNO₃) তৈরি করে, যা বৃষ্টির সঙ্গে মাটিতে পড়ে।
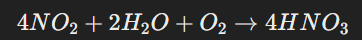
মাটিতে নাইট্রোজেন ফিক্সেশন
বজ্রপাতের মাধ্যমে উৎপন্ন নাইট্রিক অ্যাসিড বৃষ্টির সঙ্গে মাটিতে মিশে যায়। মাটিতে পৌঁছানোর পর এটি নিম্নলিখিত প্রক্রিয়ায় নাইট্রোজেন ফিক্সেশনে সহায়তা করে:
নাইট্রেট গঠনের প্রক্রিয়া:
নাইট্রিক অ্যাসিড মাটিতে দ্রবীভূত হয়ে নাইট্রেট (NO₃⁻) আয়নে রূপান্তরিত হয়।
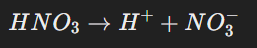
- উদ্ভিদের জন্য নাইট্রোজেন উৎস:
এই নাইট্রেট উদ্ভিদের জন্য সহজলভ্য নাইট্রোজেন উৎস হিসেবে কাজ করে। উদ্ভিদ এটি শোষণ করে প্রোটিন, অ্যামাইনো অ্যাসিড, এবং অন্যান্য নাইট্রোজেনসমৃদ্ধ যৌগ তৈরি করে। - মাটির উর্বরতা বৃদ্ধি:
বজ্রপাত-উৎপন্ন নাইট্রোজেন ফিক্সেশনের ফলে মাটির নাইট্রোজেন উপাদান বৃদ্ধি পায়, যা কৃষিক্ষেত্রে গুরুত্বপূর্ণ ভূমিকা পালন করে।
বজ্রপাতের মাধ্যমে নাইট্রোজেন চক্রে ভূমিকা
বজ্রপাত প্রাকৃতিক নাইট্রোজেন ফিক্সেশনের একটি গুরুত্বপূর্ণ মাধ্যম। এটি নাইট্রোজেন গ্যাসকে জীবিত প্রাণী এবং উদ্ভিদের জন্য সহজলভ্য রূপে রূপান্তরিত করে, যা জীবমণ্ডলে নাইট্রোজেন চক্রের একটি প্রয়োজনীয় অংশ।
শিল্পের গ্যাসীয় বর্জ্য ও বায়ুদূষণ
গ্যাসীয় বর্জ্যের প্রধান উৎস
- শিল্প কারখানা: সিমেন্ট, ইস্পাত, রাসায়নিক এবং তাপবিদ্যুৎ উৎপাদনকারী শিল্প থেকে বিভিন্ন গ্যাস নিঃসরণ হয়।
- জ্বালানি পোড়ানো: কয়লা, তেল, এবং প্রাকৃতিক গ্যাসের ব্যবহার।
- উৎপাদন প্রক্রিয়া: অ্যামোনিয়া, ক্লোরিন, সালফার ডাই-অক্সাইড এবং নাইট্রোজেন অক্সাইড নির্গমন।
গ্যাসীয় বর্জ্যের ধরন
- কার্বন ডাই-অক্সাইড (CO₂): গ্রিনহাউস গ্যাস, যা গ্লোবাল ওয়ার্মিং বৃদ্ধি করে।
- কার্বন মনোক্সাইড (CO): মানব স্বাস্থ্যের জন্য ক্ষতিকারক।
- সালফার ডাই-অক্সাইড (SO₂): অ্যাসিড বৃষ্টির অন্যতম কারণ।
- নাইট্রোজেন অক্সাইড (NOx): ত্বক ও শ্বাসযন্ত্রের ক্ষতি করে।
- মিথেন (CH₄): উচ্চ তাপমাত্রা ধরে রাখার ক্ষমতা সম্পন্ন গ্যাস।
- ভলাটাইল অর্গানিক কম্পাউন্ডস (VOC): বায়ুমণ্ডলে ওজোন স্তরের ক্ষতি করে।
বায়ুদূষণের প্রভাব
- মানবস্বাস্থ্য: শ্বাসযন্ত্রের সমস্যা, হৃদরোগ এবং ফুসফুসের ক্যান্সারের ঝুঁকি বৃদ্ধি।
- পরিবেশ: গ্লোবাল ওয়ার্মিং, ওজোন স্তর ক্ষতি এবং অ্যাসিড বৃষ্টি।
- জলবায়ু পরিবর্তন: বায়ুর তাপমাত্রা বৃদ্ধির মাধ্যমে পরিবেশের ভারসাম্য নষ্ট হয়।
- জীববৈচিত্র্য ক্ষতি: দূষণের কারণে উদ্ভিদ ও প্রাণীর ক্ষতি।
প্রতিরোধমূলক ব্যবস্থা
- পরিষ্কার প্রযুক্তি ব্যবহার: শিল্প উৎপাদনে পরিবেশবান্ধব প্রযুক্তির প্রয়োগ।
- দূষণ নিয়ন্ত্রণ যন্ত্র:
- স্ক্রাবার: সালফার ডাই-অক্সাইড এবং অন্যান্য গ্যাস অপসারণ।
- ইলেক্ট্রোস্ট্যাটিক প্রিসিপিটেটর: বায়ুর মিহি কণা ধরা।
- বিকল্প জ্বালানি: নবায়নযোগ্য শক্তি, যেমন সৌর ও বায়ু শক্তি ব্যবহার।
- নির্গমন সীমা নির্ধারণ: পরিবেশ আইন ও নীতি প্রয়োগ।
- বনায়ন: গাছ লাগিয়ে কার্বন ডাই-অক্সাইড শোষণ বৃদ্ধি করা।
শিল্পের গ্যাসীয় বর্জ্যের নিয়ন্ত্রণ পরিবেশ ও জনস্বাস্থ্যের জন্য অত্যন্ত গুরুত্বপূর্ণ। নিয়মিত পর্যবেক্ষণ এবং উন্নত প্রযুক্তি ব্যবহারে এ সমস্যার সমাধান সম্ভব।
গ্রিন হাউস প্রভাবের জন্য দায়ী গ্যাসসমূহ :
গ্রিন হাউস প্রভাবের জন্য দায়ী গ্যাসসমূহ হলো- কার্বন ডাই-অক্সাইড (ঈঙ২) - ৫০%, কৃত্রিমভাবে তৈরি ক্লোরোফ্লোরো কার্বন (ঈ.ঋ.ঈ) - ১৭%, নাইট্রাস অক্সাইড (ঘ২ঙ) - ৪%, ওজোন (ঙ৩) - ৮% এবং জলীয়বাষ্প - ২%
গ্রিন হাউস গ্যাসসমূহের উৎস :
কার্বন ডাই-অক্সাইড : বর্তমানে দিন দিন জনসংখ্যা বেড়ে চলেছে। বাড়তি লোকের চাহিদা মেটানোর জন্য বৃদ্ধি পাচ্ছে যানবাহন, কলকারখানা এবং অধিক ইটের ভাটা। ফলে উৎপন্ন হচ্ছে অধিক পরিমাণ ঈঙ২ গ্যাস। এছাড়া আগ্নেয়গিরির অগ্নুৎপাত থেকে জীব ও উদ্ভিদ দেহের পচন থেকে ভূপৃষ্ঠের চুনা পাথর নানাবিধ এসিডের সংস্পর্শে আসার ফলে বনাঞ্চলের অগ্নিকান্ডের ফলে নানারকম চুলিস্ন থেকে ক্রমবর্ধমান হারে অধিক পরিমাণ ঈঙ২ গ্যাস নির্গত হয়।
ক্লোরোফ্লোরো কার্বন : রেফ্রিজারেটর, কোল্ড স্টোর, বরফ কল ইত্যাদি ঠান্ডা রাখার জন্য ঈ.ঋ.ঈ ব্যবহার করা হয়। এছাড়া অ্যারোসল, পস্নাস্টিক ফোমের উপাদান যেমন : আরমোকোলস স্টাইরোফম, যানবাহন শীতালায়ন ও কলকারখানার ব্যবহৃত গ্যাস ঈ.ঋ.ঈ-এর উৎস। মানুষের তৈরি ঈ.ঋ.ঈ গ্যাস ওজোন স্তর ক্ষয় সাধন করে। বায়ু দূষণ তথা স্ট্রাটোস্ফেয়ারে ক্লোরিন দূষণের প্রেক্ষাপটে ওজোন ক্ষয় পরিলক্ষিত হয়। আবার জলভূমিতে পানির নিচের পানা, নানা জাতীয় পাতা ও বিভিন্ন জলজ উদ্ভিদের পচনের এবং উইপোকার অন্তে বসবাসকারী ব্যাকটেরিয়া থেকে নির্গত মিথেন গ্যাস (ঈঐ৪)-এর বিকিরণের ফলে ওজোন স্তর ক্ষয় হয় এবং ওজোন ডযড়ষব তৈরি হয়। ফলে টঠ রশ্মি সরাসরি পৃথিবীতে এসে পড়ছে। এর ফলে ত্বকে ক্যান্সার, চোখের ছানি, শরীরের রোগ প্রতিরোধ ক্ষমতা হৃ্রাস পাবে। ওজোন ঙ৩ - ২৫% শতাংশ হ্রাস পেলে সামুদ্রিক পস্নাংটন ৩৫% হ্রাস পাবে। ফলে মৎস্যসম্পদের খাদ্যের অভাব হবে। টঠ রশ্মির ফলে তুলা, তরমুজ ও বাঁধাকপিসহ কিছু শস্য উৎপাদন কমে যাবে এবং খাদ্য শস্যেও তেজস্ক্রিয়তা দেখা দেবে। উদ্ভিদের পাতা, ফল ও বীজের বৃদ্ধি ব্যাহত হবে। কয়েক শ্রেণির উদ্ভিদের সালোক সংশ্লেষণ প্রক্রিয়া ব্যাহত হবে। প্রাণীর প্রজনন ক্ষমতা হৃ্রাস পাবে এবং উদ্ভিদের ক্ষেত্রে শস্য উৎপাদন হৃ্রাস পাবে।
নাইট্রাস অক্সাইড : মটরযান শক্তি উৎপাদন কেন্দ্র পস্নাস্টিক এসিড বিস্ফোরণ নির্মাণকারী কারখানাসহ বিভিন্ন কারখানা ও কৃষিকাজে ব্যবহৃত নাইট্রোজেন সার ইত্যাদি হতে নাইট্রাস অক্সাইড নির্গত হয়।
মিথেন : প্রাকৃতিক উৎস বিশেষ করে গাছপালাসমূহ বায়ুমন্ডলে বেশি পরিমাণে হাইড্রো কার্বন নিঃসরণ করে। এদের মধ্যে মিথেনের পরিমাণ সবচেয়ে বেশি। মাটিতে ও পানির জৈব যৌগের ব্যাকটেরিয়াজনিত বিয়োজনের মাধ্যমে আশানুরূপপাওয়া যায়।
এছাড়া ধানের অবশিষ্ট অংশ গাবাধি পশুর মল কয়লাখনি জলাভূমিতে পানির নিচে পানা নানা জাতীয় পাতা ও বিভিন্ন জলজ উদ্ভিদের পচনের ফলে এবং গাছ ধ্বংসকারী উইপোকার অন্তে বসবাসকারী ব্যাকটেরিয়া থেকে গ্যাস নির্গত হয়।
গ্রিন হাউস প্রভাবের সম্ভাব্য ফলাফল: বায়ুমন্ডলে ক্রমাগত গ্রিন হাউস গ্যাস বৃদ্ধি পাচ্ছে। বায়ুমন্ডলে গ্রিন হাউস গ্যাসের বৃদ্ধিতে তাপমাত্রা বৃদ্ধিজনিত কারণে বিশ্ব পরিবেশের ওপর যে বিরূপ প্রতিক্রিয়া পরিলক্ষিত হচ্ছে তা নিম্নে উলেস্নখ করা হলো:
১। তাপমাত্রা বৃদ্ধির ফলে সমুদ্র পৃষ্ঠের উচ্চতা বৃদ্ধি পাবে। ফলে পৃথিবীর সমুদ্র উপকূলবর্তী নিচু স্থলভূমি জলমগ্ন হবে। উপকূলবর্তী নিচু ধান
উৎপাদনকারী জমির পরিমাণ হ্রাস পাবে। লবণাক্ত জমির প্রকোপে মৃত্তিকার উর্বরতা হ্রাস পাবে- ফলে ফসল উৎপাদন হ্রাস পাবে।
২। তাপমাত্রা বৃদ্ধির কারণে কিছু অঞ্চল নতুনভাবে জলমগ্ন হবে এবং কিছু অঞ্চল শুষ্ক হবে। এতে করে বাস্তুতন্ত্রের প্রাণ প্রবাহের ওপর জলবায়ুর পরিবর্তন বিরূপ প্রভাব ফেলবে।
৩। বৈশ্বিক উষ্ণায়নের ফলে মানুষই ক্ষতিগ্রস্ত হবে না বরং অসংখ্য উদ্ভিদ ও পানির অস্তিত্বও বিপন্ন হবে। অসংখ্য জীবের প্রজাতি পৃথিবী থেকে চিরতরে বিলুপ্ত হবে।
৪। পৃথিবীর গড় তাপমাত্রা ৩.ঈ - ৫.ঈ বৃদ্ধি পেলে পৃথিবীর দুই মেরুতে জমে থাকা বরফ গলতে শুরু করবে ফলে এই বরফ গলা পানি সমুদ্র পৃষ্ঠের উচ্চতা বাড়িয়ে দেবে এর ফলে জনপদ নগর পানির তলায় তলিয়ে যাওয়ার আশঙ্কা রয়েছে।
৫। সমুদ্র পৃষ্ঠের তাপমাত্রা বৃদ্ধির কারণে সামুদ্রিক ঝড় জলোচ্ছ্বাস ও টাইফুনের হার বেড়ে যাবে। বিপর্যয়ের এই সংকেত পৃথিবীর বিভিন্ন স্থানে ইতোমধ্যেই পরিলক্ষিত হচ্ছে।
৬। সামুদ্রিক পানির উষ্ণতা বৃদ্ধি পেলে সমুদ্রের পানির তাপীয় সম্প্রসারণের কারণে দ্রবীভূত কার্বন ডাই-অক্সাইডের ঘনমাত্রা হ্রাস পাবে। ফলে সামুদ্রিক বাস্তুতন্ত্র বিপন্ন হবে এবং অসংখ্য জলজ উদ্ভিদ ও প্রাণী প্রজাতি চিরতরে বিলুপ্ত হয়ে যেতে পারে।
৭। সমুদ্র পৃষ্ঠ স্ফীত হলে আবহাওয়ায় প্রকৃতি পরিবর্তিত হবে।
বর্তমান বিশ্বে গ্রিন হাউসের প্রতিকূল প্রভাব নিয়ন্ত্রণে নিম্নলিখিত ব্যবস্থাসমূহ নেয়া যেতে পারে:
১। জ্বালানি শক্তির সংক্ষেণের মাধ্যমে বায়ুমন্ডলে ঈঙ২ গ্যাসের উত্তরোত্তর পরিমাণ হ্রাস-বৃদ্ধি করা।
২। সৌর পানি বায়ু পারমাণবিক শক্তির মতো পুনঃপুনঃ ব্যবহার যোগ্য শক্তি ব্যবহারের ওপর জোর দেওয়া।
৩। প্রতি কিলোমিটারে বর্তমানের চেয়ে অনেক কম জ্বালানি তেল প্রয়োজন হয় এমন মটরযান ইঞ্জিন উদ্ভাবন করা।
৪। কার্বন ডাই-অক্সাইড উৎপাদনকারী জীবাশ্ম জ্বালানির ব্যবহার যথাসম্ভব কম করা।
৫। বনাঞ্চল সংরক্ষণ ও নিয়মিত ব্যাপক বনায়নের মাধ্যমে নতুন নতুন বনাঞ্চল সৃষ্টি করা।
৬। কৃষি কাজে রাসায়নিক সারের ব্যবহারের পরিমাণ কমিয়ে জৈব সারের ব্যবহার ব্যাপক প্রচলন করা।
৭এর সস্তা বিকল্প আবিষ্কার করা এবং ঈ.ঋ.ঈ ব্যবহার এবং উৎপাদন বন্ধ করার জন্য আন্তর্জাতিক নীতিমালা প্রণয়ন করতে হবে।
৮। উপকূলে উপযুক্ত বাঁধ ও দেওয়াল নির্মাণ করা ও সবুজ বেষ্টনী গড়ে তোলা।
৯। ত্রম্নটিপূর্ণ যানবাহনের জ্বালানির অসম্পূর্ণ দহনের ফলে এর মতো বিভিন্ন গ্রিন হাউস গ্যাস তৈরি হয় তাই ত্রম্নটিপূর্ণ যানবাহনের ব্যবহার রোধ করতে হবে।
১০। কলকারখানার ও যানবাহনের কালো ধোঁয়া বায়ুমন্ডলে নির্গত না করে উপযুক্ত ফিল্টারের মাধ্যমে পরিশোধ করে নির্গত করতে হবে।
# বহুনির্বাচনী প্রশ্ন
CFC কিভাবে ওজন স্তর ধ্বংস করে?
আমরা জানি ওজন স্ট্রাটোস্ফিয়ারে অবস্থান করে। CFC অনু যখন এই স্ট্রাটোস্ফিয়ারে পৌছায় তখন UV রশ্মি দ্বারা ভেঙ্গে ক্লোরিন ফ্রি-র্যাডিকেল গঠন করে। উক্ত ফ্রি-র্যাডিকেল খুবই সক্রিয় হওয়ায় এজনের সাথে বিক্রিয়া করে ওজন স্তরকে ক্ষয় করে।
নিম্নে বিক্রিয়া দেখানো হল-
CFCl3(→┴UV ) CFCl2.+ Cl.
Cl.+O3=ClO.+O2
O2(→┴UV )2O.
ClO.+ O.= Cl. + O2
ClO.+ O3= ClO2. + O2
# বহুনির্বাচনী প্রশ্ন
500 J
125 J
252 J
375 J
এসিড বৃষ্টি
এসিড বৃষ্টি হলো এক ধরনের বৃষ্টি, যা বায়ুমণ্ডলে সালফার ডাই অক্সাইড (SO₂) এবং নাইট্রোজেন অক্সাইড (NOₓ) গ্যাসের সাথে পানি বাষ্পের রাসায়নিক বিক্রিয়ার ফলে উৎপন্ন হয়। এর ফলে তৈরি হওয়া বৃষ্টির পানি স্বাভাবিকের তুলনায় বেশি অ্যাসিডিক হয়। এর pH সাধারণত ৫.৬-এর নিচে থাকে।
কারণসমূহ
১. শিল্প কারখানার দূষণ:
শিল্প কারখানা থেকে নির্গত সালফার ডাই অক্সাইড এবং নাইট্রোজেন অক্সাইড এসিড বৃষ্টির প্রধান কারণ।
২. যানবাহনের ধোঁয়া:
যানবাহন থেকে নির্গত গ্যাস বায়ুমণ্ডলের দূষণ বৃদ্ধি করে।
৩. জ্বালানি পুড়ানো:
কয়লা ও তেল পুড়িয়ে শক্তি উৎপাদনের সময় এসিড বৃষ্টি সৃষ্টিকারী গ্যাস নির্গত হয়।
প্রভাব
১. পরিবেশের উপর প্রভাব:
- গাছপালা এবং মাটির উপর ক্ষতিকারক প্রভাব ফেলে।
- পানির pH কমিয়ে জলজ প্রাণীর ক্ষতি করে।
২. স্থাপত্যের উপর প্রভাব:
- এসিড বৃষ্টি পাথরের স্থাপত্য এবং ভাস্কর্যের ক্ষতি করে।
- ধাতব কাঠামোর জং ধরিয়ে দেয়।
প্রতিকার
১. গ্যাস নিঃসরণ নিয়ন্ত্রণ:
শিল্প কারখানা এবং যানবাহনে দূষণ নিয়ন্ত্রণ প্রযুক্তি ব্যবহার করা।
২. পরিবেশবান্ধব জ্বালানি:
নবায়নযোগ্য শক্তির ব্যবহার বৃদ্ধি করা।
৩. বৃক্ষরোপণ:
গাছপালা কার্বন ডাই অক্সাইড শোষণ করে এবং দূষণ কমাতে সাহায্য করে।
৪. সচেতনতা বৃদ্ধি:
জনগণের মধ্যে এসিড বৃষ্টির ক্ষতি সম্পর্কে সচেতনতা বৃদ্ধি করা।
# বহুনির্বাচনী প্রশ্ন
আরহেনিয়াস সর্বপ্রথম ১৮৮৭ খ্রিস্টাব্দে এসিড-ক্ষারকের গাঠনিক সংজ্ঞা প্রদান করেন। তাঁর মতবাদ অনুসারে এসিড ও ক্ষারককে নিম্নলিখিতভাবে সংজ্ঞায়িত করা হয়।
আরহেনিয়াস তত্ত্ব অনুসারে অম্ল বা এসিড : যে সব পদার্থ জলীয় দ্রবণে বিয়োজিত হয়ে হাইড্রোজেন আয়ন (H+) দান করতে সক্ষম তারাই মূলত অম্ল বা এসিড। যেমন– HCl এ মতবাদ অনুসারে একটি এসিড, কারণ এটি জলীয় দ্রবণে আয়নিত হয়ে H+ দান করতে পারে।
আরহেনিয়াস তত্ত্ব অনুসারে ক্ষারক : যে সব পদার্থ জলীয় দ্রবণে বিয়োজিত হয়ে হাইড্রোক্সাইড আয়ন (OH-) দান করতে সক্ষম তারাই মূলত ক্ষারক। যেমন– NaOH একটি ক্ষারক, কারণ এটি জলীয় দ্রবণে বিয়োজিত হয়ে OH- দান করতে সক্ষম।
আরহেনিয়াস তত্ত্বের সীমাবদ্ধতাগুলি কি কি?
আরহেনিয়াসের তত্ত্বের সীমাবদ্ধতা
(i) আরহেনিয়াস এর মতবাদ অনুসারে কোন যৌগকে অ্যাসিডরূপে কিংবা কোন যৌগকে ক্ষারকরূপে কেবলমাত্র জলীয় দ্রবণেই গণ্য করা হয়। অন্য দ্রব্যকে নয়।
(ii) জলীয় দ্রবণে H+ আয়ন মুক্ত অবস্থায় থাকে না। এটি হাইড্রক্সোনিয়াম (H3O+) রূপে থাকে।
(iii) আরহেনিয়াস এর মতবাদ অনুযায়ী C6H5NH2 বা CH3NH2 কে ক্ষার বলা যাবে না যদিও এরা ক্ষার।
(iv) হাইড্রোজেন পরমাণু একটি ইলেকট্রন বর্জন করে H+ আয়ন উৎপন্ন হয়। এর ইলেকট্রনের কোনাে কক্ষক নাই, কেবলমাত্র কেন্দ্র আছে। এর ব্যাসার্ধ প্রায় 10-13 cm. স্বল্প আয়তনে এক একক তড়িৎ থাকায় আকর্ষণ বল তীব্র। তাই ইলেকট্রন জোড়কে তীব্রভাবে আকর্ষণ করে। এটি জলের অক্সিজেন পরমাণুর ইলেকট্রন জোড়কে আকর্ষণ করে এবং প্রথম যােজ্যতার মাধ্যমে HO+ আয়ন তৈরি করে।
# বহুনির্বাচনী প্রশ্ন
ব্রনস্টেড-লাউরি তত্ত্ব হলো একটি অম্ল-ক্ষার তত্ত্ব যা ১৯২৩ সালে জোহানেস নিকোলাস ব্রনস্টেড এবং টমাস মার্টিন লাউরি পৃথক পৃথকভাবে প্রকাশ করেন। এ তত্ত্বের মূলকথা হলোঃ যখন অম্ল ক্ষারের সাথে বিক্রিয়া করে তখন একটি প্রোটন (হাইড্রোজেন ক্যাটায়ন বা H+) বিনিময়ের মাধ্যমে অম্ল তার অনুবন্ধী ক্ষার এবং ক্ষার তার অনুবন্ধী অম্ল তৈরি করে। এ তত্ত্বটিকে আরেনিয়াসের তত্ত্বের একটা সাধারণীকরণ বলা চলে।
আরেনিয়াসের তত্ত্বমতে অম্ল হলো সে সকল পদার্থ যারা জলীয় দ্রবণে বিয়োজিত হয়ে H+(হাইড্রোজেন আয়ন) দান করে এবং ক্ষার হলো এমন সব পদার্থ যারা জলীয় দ্রবণে বিয়োজিত হয়ে OH−(হাইড্রক্সাইড আয়ন বা হাইড্রক্সিল) দান করে।
১৯২৩ সালে ভৌত রসায়নবিদ ডেনমার্কের জোহানেস নিকোলাস ব্রনস্টেড এবং ইংল্যান্ডের টমাস মার্টিন লাউরি পৃথক পৃথকভাবে তাদের নামধারী এ তত্ব প্রস্তাব করেন। ব্রনস্টেড-লাউরি তত্ত্বে অম্ল ও ক্ষারকে সংজ্ঞায়িত করা হয়েছে এদের পারস্পারিক প্রতিক্রিয়ার ভিত্তিতে যা অধিকাংশ ক্ষেত্রেই সত্য। একে সাম্যাবস্থার রাশিমালা দিয়ে প্রকাশ করা হয়ে থাকে:
অম্ল + ক্ষার
অম্লকে HA ধরে নিলে উক্ত সমীকরণটিকে এভাবে লেখা যায়:
HA + B
এখানে সাম্যাবস্থার চিহ্ন (
১৯২৩ সালে জোহান্নেস নিকোলাস ব্রনস্টেড এবং থমাস মার্টিন লাউরি এই মতবাদটি প্রস্তাব করেন। সেখানে বলা হয়েছে, এসিড প্রোটন তথা H+ আয়ন দান করে আর ক্ষারক সেই H+ আয়নটি গ্রহণ করে। ব্যাপারটি অনেকটা বল ছুড়ে মারা ও ধরার মতো। ধরো, মুশফিক যদি একটা বল ছুড়ে মারে তবে সে হবে এসিড। আর সাকিব যদি সেই বলটা ক্যাচ ধরে তবে সে হবে ক্ষারক। বল ছোড়াটাকে আমরা প্রোটন ছোড়ার সঙ্গে তুলনা করেছি আর কি! তো একটা উদাহরণ দেখে নেওয়া যাক :
HCl + NH3 <=> Cl- + NH4+
এখানে দেখো HCl যাকে আমরা মুশফিক ধরতে পারি একটা H+ ছুড়ে দিয়ে Cl- এ পরিণত হয়েছে, আর NH3 তথা সাকিব সেই প্রোটন বা H+ গ্রহণ করে NH4+ আয়নে পরিণত হয়েছে। তার মানে HCl একটি এসিড, কারণ সে প্রোটন দেয় আর NH3 একটি ক্ষারক, কারণ সে প্রোটন গ্রহণ করে। ব্যাপারটা আরো সহজ করে বুঝতে চাইলে বিক্রিয়ার বাঁ পক্ষটাকে চিন্তা করবে প্রোটন ছোড়ার আগ মুহূর্তের ছবি আর ডান পক্ষকে ধরে নেবে ছুড়ে মারা প্রোটন ধরার পরের ছবি।
খেয়াল করে দেখো বল কিন্তু এখন সাকিবের হাতে। তার মানে সাকিব এখন বল ছুড়তে পারে এবং মুশফিক সেটা গ্রহণ করতে পারে।
তার মানে উভয়মুখী বিক্রিয়াটিতে উৎপাদ থেকেও বিক্রিয়ক উৎপন্ন হতে পারে। অর্থাৎ NH4+ তার অতিরিক্ত H+টাকে Cl-কে দিয়ে এসিডের মতো আচরণ করবে, আর Cl- সেই H+ টাকে ধরে ক্ষারকের মতো আচরণ করবে। এ ক্ষেত্রে বিক্রিয়ার ডান পক্ষটাকে চিন্তা করবে প্রোটন ছোড়ার আগ মুহূর্তের ছবি আর বাঁ পক্ষকে ধরে নেবে ছুড়ে মারা প্রোটন ধরার পরের ছবি।
এখন অনুবন্ধী এসিড, ক্ষারক কী তা বুঝে নিই। একেবারে সহজ কথায় বললে বিক্রিয়ার ডান পক্ষে যে ক্ষারক থাকবে তা হবে বাঁ পক্ষের এসিডের অনুবন্ধী ক্ষারক আর ডান পক্ষে যে এসিড থাকবে তা হবে বাঁ পক্ষের ক্ষারকের অনুবন্ধী এসিড। বাঁ পক্ষের এসিড আর ডান পক্ষে তার অনুবন্ধী ক্ষারককে আমরা বলব অনুবন্ধী যুগল। একইভাবে বাঁ পক্ষের ক্ষারক আর ডান পক্ষে তার অনুবন্ধী এসিডকে আমরা বলব আরেকটি অনুবন্ধী যুগল!
উদাহরণে HCl একটা H+ আয়ন ত্যাগ করে Cl- হয়েছে। এই Cl- আবার একটা H+ গ্রহণ করতে সক্ষম। তার মানে HCl একটি এসিড আর Cl- হলো HCl- এর অনুবন্ধী ক্ষারক। আর এরা পরস্পরের অনুবন্ধী এসিড-ক্ষারক যুগল। আবার NH3 একটা H+ গ্রহণ করে NH4+ গঠন করে। এই NH4+ আবার একটা H+ ত্যাগ করতে সক্ষম। তার মানে NH3 একটা ক্ষারক আর NH4+ হলো NH3 এর অনুবন্ধী এসিড। আর এরা পরস্পরের অনুবন্ধী এসিড-ক্ষারক যুগল।
আরেকটি উদাহরণ দেখা যাক :
HCl + H2O <=> H3O+ + Cl-
এ বিক্রিয়ায় HCl-এর অনুবন্ধী ক্ষারক হলো Cl- ও H2O-এর অনুবন্ধী এসিড হলো H3O+
যে সমস্ত যৌগ নিঃসঙ্গ ইলেকট্রন জোড় গ্রহণে সক্ষম তাদেরকে লুইস অম্ল বলা হয় এবং যারা নিঃসঙ্গ ইলেকট্রন প্রদান করতে পারে তাদের লুইস ক্ষার বলা হয়। সাধারণত এই ইলেকট্রন গ্রহণ ও প্রদান অসমযোজী বন্ধন গঠনের মাধ্যমে সাধিত হয়। যেমন অ্যামোনিয়া একটি লুইস ক্ষার যা তার নিজের ইলেকট্রন অন্য যৌগকে প্রদান করতে পারে (যেমন- বোরন ট্রাইফ্লুরাইড)। এক্ষেত্রে বোরন ট্রাইফ্লুরাইড হল লুইস অম্ল।
মিঠা পানির উৎস ও গুরুত্ব
মিঠা পানির উৎস
১. নদী ও হ্রদ:
নদী এবং হ্রদ মিঠা পানির প্রধান উৎস। এগুলো থেকে পানীয় জল, সেচ এবং বিদ্যুৎ উৎপাদনের জন্য পানি সংগ্রহ করা হয়।
২. উপনদী ও ঝর্ণা:
উপনদী এবং ঝর্ণা প্রাকৃতিকভাবে পাহাড় বা উঁচু এলাকা থেকে প্রবাহিত হয়ে মিঠা পানির চাহিদা মেটায়।
৩. তলস্তরের পানি (Groundwater):
তলস্তরের পানি বা ভূগর্ভস্থ পানি কূপ এবং টিউবওয়েলের মাধ্যমে উত্তোলন করে ব্যবহৃত হয়। এটি নিরাপদ পানির একটি গুরুত্বপূর্ণ উৎস।
৪. বরফ এবং হিমবাহ:
উত্তর ও দক্ষিণ মেরু অঞ্চলের বরফ এবং হিমবাহের গলিত পানি মিঠা পানির একটি বিশাল উৎস।
৫. বৃষ্টির পানি:
বৃষ্টির পানি সরাসরি ব্যবহারযোগ্য এবং প্রাকৃতিক চক্রের মাধ্যমে নদী, হ্রদ ও ভূগর্ভস্থ পানিতে যুক্ত হয়।
মিঠা পানির গুরুত্ব
১. জীবনধারণে অপরিহার্য:
মানব, প্রাণী এবং উদ্ভিদের জীবনধারণে মিঠা পানি অপরিহার্য। এটি পানীয় জল, খাদ্য উৎপাদন এবং স্বাস্থ্য রক্ষায় গুরুত্বপূর্ণ ভূমিকা পালন করে।
২. কৃষি ও খাদ্য উৎপাদন:
সেচ কার্যক্রমের মাধ্যমে মিঠা পানি কৃষি জমিতে সরবরাহ করা হয়, যা খাদ্যশস্য উৎপাদনের মূল ভিত্তি।
৩. শিল্পকার্য:
শিল্প কারখানাগুলোতে কাঁচামাল পরিষ্কার, শীতলীকরণ এবং উৎপাদন প্রক্রিয়ায় মিঠা পানি ব্যবহৃত হয়।
৪. বিদ্যুৎ উৎপাদন:
হাইড্রোইলেকট্রিক পাওয়ার প্ল্যান্টের মাধ্যমে মিঠা পানি থেকে বিদ্যুৎ উৎপন্ন করা হয়।
৫. প্রাকৃতিক পরিবেশের ভারসাম্য:
নদী, হ্রদ এবং জলাভূমি জীববৈচিত্র্য সংরক্ষণে সহায়ক। মিঠা পানি জীবজগতের প্রাকৃতিক আবাসস্থল তৈরি করে।
শিল্প বর্জ্য ও পানি দূষণ
শিল্প বর্জ্যের প্রকারভেদ:
শিল্প থেকে নির্গত বর্জ্য বিভিন্ন প্রকার হতে পারে, যেমন:
- তরল বর্জ্য:
কারখানার নির্গত রাসায়নিক দ্রবণ, তেল, এবং রঞ্জক। - কঠিন বর্জ্য:
প্লাস্টিক, ধাতব অংশ, এবং অন্যান্য কঠিন পদার্থ। - গ্যাসীয় বর্জ্য:
রাসায়নিক কারখানার নির্গত বিষাক্ত গ্যাস। - জৈব বর্জ্য:
খাদ্য প্রক্রিয়াকরণ শিল্পের অবশিষ্টাংশ।
পানি দূষণের কারণ:
- রাসায়নিক নির্গমন:
কারখানার রাসায়নিক দ্রব্য সরাসরি পানিতে ফেলা হলে পানি দূষিত হয়। - তেল নির্গমন:
জাহাজ এবং তেল শোধনাগার থেকে নির্গত তেল সমুদ্র এবং নদীর পানি দূষিত করে। - কঠিন বর্জ্য:
প্লাস্টিক এবং ধাতব উপাদান পানির উৎসে ফেলা হলে তা দূষণ সৃষ্টি করে। - জৈব বর্জ্য:
অপরিশোধিত বর্জ্য পানিতে মিশে অক্সিজেনের অভাব সৃষ্টি করে।
প্রভাব:
- মানুষের উপর প্রভাব:
দূষিত পানি পানে এবং ব্যবহারে বিভিন্ন রোগ যেমন ডায়রিয়া, টাইফয়েড ইত্যাদি হতে পারে। - জীববৈচিত্র্যের উপর প্রভাব:
জলজ প্রাণীর স্বাভাবিক বাসস্থান ধ্বংস হয়, এবং অনেক প্রজাতি বিলুপ্তির সম্মুখীন হয়। - পরিবেশের উপর প্রভাব:
দূষিত পানি মাটির উর্বরতা হ্রাস করে এবং পরিবেশগত ভারসাম্য নষ্ট করে। - অর্থনৈতিক ক্ষতি:
দূষিত পানি কৃষি, মৎস্য এবং পর্যটন শিল্পের জন্য ক্ষতিকর।
প্রতিরোধমূলক ব্যবস্থা:
- শিল্প বর্জ্যের পরিশোধন:
কারখানাগুলোর বর্জ্য শোধনাগার স্থাপন বাধ্যতামূলক করা। - নিয়ন্ত্রণ ব্যবস্থা:
সরকারের কঠোর আইন প্রয়োগ এবং পর্যবেক্ষণ কার্যক্রম। - পুনর্ব্যবহার:
শিল্প বর্জ্য পুনর্ব্যবহারের ব্যবস্থা গ্রহণ। - সচেতনতা বৃদ্ধি:
জনগণের মধ্যে দূষণের ক্ষতি সম্পর্কে সচেতনতা বাড়ানো। - জৈব প্রযুক্তি ব্যবহার:
বর্জ্য শোধনে প্রাকৃতিক এবং পরিবেশবান্ধব প্রযুক্তির ব্যবহার।
# বহুনির্বাচনী প্রশ্ন
জৈব বর্জ্যা থাকলে DO বেশি হয়।
জীবাণু উপস্থিতি DO বাড়িয়ে দেয়
DO ৪.০-৬.০ পিপিএম থাকা প্রয়োজন
DO ৪.০ পিপিএম এর নিচে থাকা প্রয়োজন
পানির প্রাকৃতিক দূষণ: আর্সেনিক দূষণ
পানির প্রাকৃতিক দূষণের অন্যতম মারাত্মক সমস্যা হলো আর্সেনিক দূষণ। আর্সেনিক একটি প্রাকৃতিক রাসায়নিক উপাদান যা ভূগর্ভস্থ পানিতে মিশে গিয়ে মানুষের স্বাস্থ্যের জন্য বিপজ্জনক হয়ে উঠতে পারে। এটি প্রধানত প্রাকৃতিক ভূতাত্ত্বিক প্রক্রিয়ার মাধ্যমে পানিতে প্রবেশ করে।
আর্সেনিক দূষণের কারণ
- ভূতাত্ত্বিক গঠন: ভূগর্ভস্থ শিলাস্তরের মধ্যে প্রাকৃতিকভাবে থাকা আর্সেনিক পানিতে মিশে যায়।
- কৃষি ও শিল্প কারখানা: কীটনাশক ও শিল্পজাত রাসায়নিক ব্যবহার আর্সেনিক দূষণ বাড়িয়ে তোলে।
- অপ্রতুল পানি ব্যবস্থাপনা: সঠিকভাবে ভূগর্ভস্থ পানি উত্তোলনের অভাবে আর্সেনিক দূষণ ত্বরান্বিত হয়।
আর্সেনিক দূষণের প্রভাব
মানব স্বাস্থ্যের উপর প্রভাব
- আর্সেনিকজনিত চর্মরোগ: ত্বকে দাগ, ফোসকা, এবং ক্যানসারের ঝুঁকি বৃদ্ধি।
- অঙ্গপ্রত্যঙ্গের ক্ষতি: কিডনি, লিভার এবং হার্টের কার্যক্ষমতা হ্রাস পায়।
- মানসিক ও শারীরিক বিকলাঙ্গতা: দীর্ঘমেয়াদে আর্সেনিকযুক্ত পানি পান করলে মানসিক ও শারীরিক স্বাস্থ্য অবনতি ঘটে।
পরিবেশের উপর প্রভাব
- জলজ জীববৈচিত্র্যের ক্ষতি: আর্সেনিক দূষণ জলজ জীবের প্রজনন এবং জীবনচক্র ব্যাহত করে।
- মাটির উর্বরতা হ্রাস: আর্সেনিক দূষণের কারণে মাটির গুণমান ও উর্বরতা হ্রাস পায়।
প্রতিরোধমূলক ব্যবস্থা
- নিরাপদ পানির উৎস: বিকল্প পানির উৎস যেমন গভীর নলকূপ বা পরিশোধিত পানি ব্যবহার করা।
- সচেতনতা বৃদ্ধি: আর্সেনিক দূষণের ক্ষতি ও প্রতিরোধ সম্পর্কে জনগণকে সচেতন করা।
- সরকারি উদ্যোগ: নিরাপদ পানীয় জল সরবরাহ নিশ্চিত করা এবং দূষণ নিয়ন্ত্রণে আইন প্রয়োগ।
সারাংশ
আর্সেনিক দূষণ একটি গুরুতর সমস্যা, যা মানুষের স্বাস্থ্য ও পরিবেশের উপর মারাত্মক প্রভাব ফেলে। সঠিক ব্যবস্থাপনা এবং সচেতনতা বৃদ্ধি করে এটি প্রতিরোধ করা সম্ভব। নিরাপদ পানি নিশ্চিত করার জন্য সমন্বিত প্রচেষ্টা অপরিহার্য।
# বহুনির্বাচনী প্রশ্ন
খাদ্য শৃঙ্খলে ভারী ধাতু (As, Cr, Pb, Cd) যুক্ত হওয়ার কারণ
- প্রাকৃতিক কারণ:
- ভূগর্ভস্থ পানিতে প্রাকৃতিকভাবে ভারী ধাতুর উপস্থিতি, বিশেষ করে আর্সেনিক (As)।
- আগ্নেয়গিরির কার্যকলাপ থেকে ভারী ধাতু মুক্ত হওয়া।
- শিল্প ও মানব কার্যক্রম:
- শিল্প বর্জ্য: ট্যানারি, ধাতু প্রক্রিয়াকরণ কারখানা এবং রাসায়নিক কারখানার বর্জ্যে ক্রোমিয়াম (Cr) এবং সীসা (Pb)।
- কৃষি রাসায়নিক: কীটনাশক এবং সার ব্যবহারে ক্যাডমিয়াম (Cd) এবং আর্সেনিকের প্রবেশ।
- প্লাস্টিক এবং রঙ ব্যবহার: পেইন্ট এবং প্লাস্টিক পণ্য থেকে সীসা ও ক্যাডমিয়াম।
- ইলেকট্রনিক বর্জ্য: পুরনো ইলেকট্রনিক যন্ত্রপাতি থেকে ভারী ধাতু নির্গমন।
- দূষিত পানি ও মাটি:
- ভারী ধাতু দূষিত পানি থেকে উদ্ভিদে প্রবেশ করে এবং খাদ্য চক্রে স্থান পায়।
- দূষিত মাটিতে চাষাবাদ করলে ভারী ধাতু শস্যে প্রবেশ করে।
- বায়ুদূষণ:
- ভারী ধাতুর কণা শিল্প কারখানা এবং যানবাহনের ধোঁয়া থেকে বায়ুমণ্ডলে ছড়িয়ে পড়ে এবং সেগুলি বৃষ্টির মাধ্যমে মাটিতে জমা হয়।
খাদ্য শৃঙ্খলে ভারী ধাতুর প্রভাব
১. মানুষের উপর প্রভাব:
- আর্সেনিক (As):
- দীর্ঘমেয়াদে পানিতে আর্সেনিকের উপস্থিতি ক্যান্সার, চর্মরোগ, এবং স্নায়বিক সমস্যা সৃষ্টি করে।
- ক্রোমিয়াম (Cr):
- ক্রোমিয়ামের উচ্চ মাত্রা কিডনি এবং লিভারের ক্ষতি করে।
- ক্রোমিয়াম(VI) কার্সিনোজেনিক প্রভাব ফেলতে পারে।
- সীসা (Pb):
- স্নায়ুতন্ত্রের কার্যকারিতা ব্যাহত করে, বিশেষ করে শিশুদের মধ্যে বুদ্ধিমত্তা হ্রাস পায়।
- রক্তস্বল্পতা এবং কিডনি বিকল হতে পারে।
- ক্যাডমিয়াম (Cd):
- হাড়ের ভঙ্গুরতা এবং কিডনি ক্ষতির কারণ।
- উচ্চমাত্রায় দীর্ঘমেয়াদে শ্বাসযন্ত্রে সমস্যা সৃষ্টি করে।
২. উদ্ভিদের উপর প্রভাব:
- ভারী ধাতু মাটির পুষ্টি শোষণ ক্ষমতা হ্রাস করে।
- উদ্ভিদে বায়োক্যুমুলেশন (ধীরে ধীরে ভারী ধাতু জমা) ঘটে, যা খাদ্য চক্রে প্রবেশ করে।
- উদ্ভিদের বৃদ্ধি এবং উৎপাদনশীলতা হ্রাস পায়।
৩. প্রাণীর উপর প্রভাব:
- খাদ্য বা পানি থেকে ভারী ধাতু গ্রহণ করে প্রাণীর দেহে জমা হয়।
- স্নায়ুতন্ত্র, প্রজনন ক্ষমতা, এবং রোগ প্রতিরোধ ক্ষমতা কমে যায়।
- ভারী ধাতু বিষক্রিয়া প্রাণীর মৃত্যু ঘটাতে পারে।
৪. পরিবেশের উপর প্রভাব:
- ভারী ধাতু মাটিতে জমে দীর্ঘমেয়াদে মাটির উর্বরতা নষ্ট করে।
- জলজ প্রাণী ও উদ্ভিদের উপর ক্ষতিকর প্রভাব ফেলে, বিশেষত দূষিত পানিতে ভারী ধাতুর উপস্থিতি।
ভারী ধাতুর কারণে খাদ্য শৃঙ্খলের ওপর এই নেতিবাচক প্রভাব মানুষের স্বাস্থ্য, পরিবেশ এবং অর্থনৈতিক উন্নয়নে একটি বড় চ্যালেঞ্জ হয়ে দাঁড়ায়।
# বহুনির্বাচনী প্রশ্ন
দ্রবণের প্রকারভেদ
১. গঠন অনুযায়ী দ্রবণ
- অম্লীয় দ্রবণ (Acidic Solution): pH মান ৭-এর চেয়ে কম। যেমন: লেবুর রস।
- ক্ষারীয় দ্রবণ (Basic Solution): pH মান ৭-এর চেয়ে বেশি। যেমন: সাবানের জল।
- নিরপেক্ষ দ্রবণ (Neutral Solution): pH মান ৭। যেমন: বিশুদ্ধ পানি।
২. দ্রাবক অনুযায়ী দ্রবণ
- জলীয় দ্রবণ (Aqueous Solution): পানিকে দ্রাবক হিসেবে ব্যবহার করা হয়। যেমন: লবণের জল।
- অজলীয় দ্রবণ (Non-Aqueous Solution): অন্য কোনো তরল দ্রাবক হিসেবে ব্যবহৃত হয়। যেমন: বেনজিনে সালফার দ্রবণ।
৩. দ্রবণের ঘনত্ব অনুযায়ী
- সরল দ্রবণ (Dilute Solution): দ্রবণের দ্রাবকের তুলনায় দ্রব পদার্থের পরিমাণ কম।
- সান্দ্র দ্রবণ (Concentrated Solution): দ্রবণের দ্রাবকের তুলনায় দ্রব পদার্থের পরিমাণ বেশি।
৪. দ্রবণের অবস্থা অনুযায়ী
- তরল দ্রবণ (Liquid Solution): যেমন: চিনি জল।
- গ্যাসীয় দ্রবণ (Gaseous Solution): যেমন: বায়ু (গ্যাসের মিশ্রণ)।
- কঠিন দ্রবণ (Solid Solution): যেমন: ব্রোঞ্জ (তামা ও টিনের মিশ্রণ)।
৫. তাপমাত্রা অনুযায়ী দ্রবণ
- অধিবৃত্ত দ্রবণ (Saturated Solution): দ্রাবকে আর দ্রব পদার্থ দ্রবীভূত করা যায় না।
- অধিবৃত্তহীন দ্রবণ (Unsaturated Solution): দ্রাবকে আরও দ্রব পদার্থ দ্রবীভূত করা সম্ভব।
- অধিবৃত্তোত্তীর্ণ দ্রবণ (Supersaturated Solution): দ্রব পদার্থ অতিরিক্ত পরিমাণে দ্রবীভূত থাকে।
৬. কণার আকার অনুযায়ী দ্রবণ
- সত্যিকারের দ্রবণ (True Solution): দ্রব কণার আকার ১ ন্যানোমিটারের চেয়ে কম।
- কলোয়েড দ্রবণ (Colloidal Solution): দ্রব কণার আকার ১ থেকে ১০০০ ন্যানোমিটার।
- স্থূল দ্রবণ (Suspension): দ্রব কণার আকার ১০০০ ন্যানোমিটারের বেশি।
সারাংশ
দ্রবণের প্রকারভেদ বিভিন্ন রাসায়নিক ও ভৌত বৈশিষ্ট্যের ওপর নির্ভর করে এবং এগুলো বিভিন্ন ক্ষেত্রে ভিন্নভাবে গুরুত্বপূর্ণ ভূমিকা পালন করে।
# বহুনির্বাচনী প্রশ্ন
দূষক পদার্থসমূহের বায়ু ও পানিতে দ্রবীভূত থাকার কৌশল
বায়ু ও পানিতে দূষক পদার্থের দ্রবীভূত থাকার প্রক্রিয়া প্রাকৃতিক এবং মানবসৃষ্ট উভয় কারণেই ঘটে। রাসায়নিক গঠন, তাপমাত্রা এবং পরিবেশগত অবস্থার উপর ভিত্তি করে দূষক পদার্থ বায়ু বা পানির সাথে মিশে থাকে এবং পরিবেশে এর দীর্ঘমেয়াদী প্রভাব ফেলে।
বায়ুতে দূষক পদার্থের দ্রবীভূত থাকার কৌশল
- গ্যাসীয় দূষক পদার্থ:
- সালফার ডাই-অক্সাইড (SO₂), নাইট্রোজেন অক্সাইড (NOₓ), এবং কার্বন মনোক্সাইড (CO) বায়ুমণ্ডলে মিশে গ্যাসীয় দূষণ সৃষ্টি করে।
- উচ্চ তাপমাত্রায় গ্যাসের গতিশীলতা বাড়ে এবং এটি দ্রুত পরিবেশে ছড়িয়ে পড়ে।
- কণা দূষণ (Particulate Matter):
- সূক্ষ্ম কণা (PM2.5 এবং PM10) বায়ুর সাথে মিশে দীর্ঘ সময় ভেসে থাকে।
- বায়ু প্রবাহের মাধ্যমে এটি দূরবর্তী এলাকায় স্থানান্তরিত হয়।
- আর্দ্রতার ভূমিকা:
- উচ্চ আর্দ্রতার পরিবেশে গ্যাসীয় দূষক পদার্থ পানির কণার সাথে মিশে অ্যাসিড বৃষ্টি সৃষ্টি করতে পারে।
- উদাহরণ: সালফার ডাই-অক্সাইড এবং নাইট্রোজেন অক্সাইড পানির সাথে মিশে সালফিউরিক অ্যাসিড এবং নাইট্রিক অ্যাসিড তৈরি করে।
পানিতে দূষক পদার্থের দ্রবীভূত থাকার কৌশল
- রাসায়নিক দ্রবণীয়তা:
- কিছু দূষক যেমন অ্যামোনিয়া (NH₃) এবং কার্বন ডাই-অক্সাইড (CO₂) পানিতে খুব সহজে দ্রবীভূত হয়।
- দ্রবণীয়তা তাপমাত্রার উপর নির্ভর করে; ঠাণ্ডা পানিতে গ্যাস দ্রবণীয়তা বেশি।
- পানির pH এবং দূষণ:
- অ্যাসিডিক বা ক্ষারীয় দূষক পদার্থ পানির pH পরিবর্তন করে।
- উদাহরণ: অ্যামোনিয়া পানিতে দ্রবীভূত হয়ে অ্যালকালাইন পরিবেশ তৈরি করে।
- জৈব দূষক পদার্থ:
- তেল, গ্রিজ এবং রাসায়নিক সার পানির উপরিভাগে ভাসমান অবস্থায় থাকে এবং ধীরে ধীরে দ্রবীভূত হয়।
- জৈব পদার্থ ব্যাকটেরিয়া দ্বারা ভাঙা হলে অক্সিজেনের অভাব দেখা দেয়।
পরিবেশগত ও স্বাস্থ্যগত প্রভাব
- বায়ু ও পানিতে দ্রবীভূত দূষক পদার্থ শ্বাসকষ্ট, ফুসফুসের রোগ এবং জলজ প্রাণীর মৃত্যুর কারণ হতে পারে।
- পানিতে দ্রবীভূত অ্যাসিড ও ভারী ধাতু মানবদেহে বিষক্রিয়ার সৃষ্টি করে।
দূষণ নিয়ন্ত্রণ কৌশল
- ফিল্টারিং ও স্ক্রাবার: বায়ুতে কণা এবং গ্যাসীয় দূষণ কমানোর জন্য শিল্পে ফিল্টার এবং স্ক্রাবার ব্যবহার করা হয়।
- জল পরিশোধন: পানিতে দ্রবীভূত রাসায়নিক ও জৈব দূষণ কমাতে পরিশোধন প্রযুক্তি ব্যবহার করা হয়।
- প্রাকৃতিক সমাধান: উদ্ভিদ এবং জলজ প্রাণীর মাধ্যমে দূষক পদার্থ শোষণ করা সম্ভব।
# বহুনির্বাচনী প্রশ্ন
Read more




















